

| 压强/MPa 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
分析 (1)二步的化学方程式可表示为:SO2+V2O5?SO3+V2O4,4VOSO4+O2?2V2O5+4SO3,过程分析可知催化剂室改变反应速率参与反应过程,但化学性质和质量不变;
(2)根据图象分析影响平衡的因素;
(3)根据化学平衡计算的三段式进行计算,压强之比等于物质的量之比,依据平衡常数概念计算;依据条件改变和化学平衡移动方向分析判断选项;
(4)将x mol•L-1的氨水与ymol•L-1的硫酸等体积混合,反应后溶液显中性,根据电荷守恒,溶液中c(OH-)=1×10-7mol/L,根据K=$\frac{c(N{H}_{4}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:(1)依据图1中的转化关系和化学方程式分析,V2O5参与反应先做氧化剂把二氧化硫氧化为三氧化硫,本身被还原为图中产物V2O4;根据氧化还原反应的实质写出并配平a步化学方程式SO2+V2O5?SO3+V2O4;C是VOSO4转化为SO3,此过程需要重新生成催化剂V2O5,故答案为:V2O5;
(2)2SO2(g)+O2(g)?2SO3(g),反应是放热反应,反应前后气体体积减小,依据反应速率与时间的关系图象分析,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;由于t3时逆反应速率大于正反应速率,平衡向逆反应方向移动,所以平衡混合物中SO3的含量最高的一段时间是t2-t3,故答案为:增大压强;t2-t3;
(3)体系总压强为0.10M Pa,此时二氧化硫的转化率为80%
2SO2 +O2 $\frac{\underline{催化剂}}{△}$ 2SO3
起始量(mol) 2 1 0
变化量 (mol)2×0.8 0.8 2×0.8
平衡量 (mol) 0.4 0.2 1.6
平衡时各物质的浓度为:[SO2]=0.08mol/L,[O2]=0.04mol/L,[SO3]=0.32mol/L 代入平衡常数的计算式得到
平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})c({O}_{2})}$=$\frac{0.3{2}^{2}}{0.0{8}^{2}×0.04}$=400 L•mol-1,
则反应2SO3?2SO2+O2 在550℃时的平衡常数K=$\frac{1}{400}$=2.5×10-3 ;
2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,反应是气体体积减小的放热反应,依据平衡移动原理分析;
A.升高温度,平衡逆向进行,n(SO3)/n(SO2)比值减小,故A不符合;
B.充入He(g),使体系总压强增大,分压不变,平衡不动,n(SO3)/n(SO2)比值不变,故B不符合;
C.再充入2mol SO2和1mol O2,相当于增大压强平衡正向进行,n(SO3)/n(SO2)比值增大,故C符合;
D.再充入1mol SO2和1mol O2,二氧化硫转化率增大,n(SO3)/n(SO2)比值增大,故D符合;
故答案为:2.5×10-3;CD;
(4)溶液呈中性,c(H+)=c(OH-),电荷守恒得:c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)=2c(SO42-),将x mol•L-1的氨水与ymol•L-1的硫酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=2c(SO42-)=ymol/L,混合后反应前c(NH3•H2O)=$\frac{x}{2}$mol/L,则反应后c(NH3•H2O)=($\frac{x}{2}$-y)mol/L,
则K=$\frac{c(N{H}_{4}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{y×1×1{0}^{-7}}{\frac{x}{2}-y}$=$\frac{2×1{0}^{-7}y}{x-2y}$,故答案为:=;$\frac{2×1{0}^{-7}y}{x-2y}$.
点评 本题考查化学平衡的影响因素,催化剂作用分析,平衡常数计算应用,题目难度不大,注意计较两容器的不同状态,从压强对平衡移动的影响角度分析.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:计算题
取1.43 g Na2CO3·xH2O溶于水配成10 mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0 mL,并收集到112 m L CO2(标准状况)。试计算:
L CO2(标准状况)。试计算:
⑴ CO2的物质的量
⑵ Na2CO3·xH2O的物质的量。
⑶ x的值。
⑷所用稀盐酸的物质的浓度。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列四种化合物中,不能与氢氧化钠溶液反应的是
A.碳铵(碳酸氢铵) B.二氧化硅 C.氧化铝 D.一氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述生成Ni(CO)4(g)的反应为放热反应 | |
| B. | 在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol•L-1,则此时v(正)<v(逆) | |
| C. | 恒温恒压下,向容器中再充入少量的Ar,上述平衡将正向移动 | |
| D. | 恒温恒容下,向容器中再充入少量Ni(CO)4(g),达新平衡时,CO 的百分含量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡状态时A、B、C、D的反应速率均为0 | |
| B. | C的平均反应速率为:0.15mol/(L•min) | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | 此时,V(A):V(B):V(C):V(D)=4:3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=7的溶液呈中性 | |
| B. | pH值为0的溶液中c(H+)=0 mol/L | |
| C. | pH=5的溶液中[H+]=1.0×10-5 mol•L-1 | |
| D. | pH=5的溶液中[OH-]=1.0×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 肯定不含I- | B. | 肯定不含NH4+ | C. | 肯定不含Cu2+ | D. | 肯定不含SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液和盐酸;CO32-+2H+═H2O+CO2↑ | |
| B. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ | |
| C. | 向硫化钠溶液中滴入氯化铝溶液:2Al3++3S2-═Al2S3↓ | |
| D. |  溶液通入少量CO2: 溶液通入少量CO2: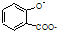 +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com