
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为: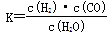 ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
(1)C+H2O (g)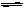 CO + H2 (2分)
CO + H2 (2分)
(2)①0.08mol/(L·min) ② > ③ 正向 ,不变 (各1分,共4分)
(3)BC (2分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡表达式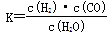 可知,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据原子守恒可知,另一反应物为固体C,因此该反应的化学方程式为C(s)+H2O(g)
可知,生成物为CO、H2,反应物含有H2O,三者化学计量数分别为1、1、1,根据原子守恒可知,另一反应物为固体C,因此该反应的化学方程式为C(s)+H2O(g) CO(g)+H2(g)。
CO(g)+H2(g)。
(2)①由表中数据可知,l0min内甲醇的浓度变化为0.4mol/L,所以用甲醇表示的反应速率v(CH3OH)=0.4mol/L÷10min=0.04mol/(L?min)。又因为速率之比等于化学计量数之比,故v(H2)=2v(CH3OH)=2×0.04mol/(L?min)=0.08mol/(L?min)。
②10min时,CO的浓度为0.1mol/L,氢气的浓度为0.2mol/L,甲醇的浓度为0.4mol/L,故此时的浓度商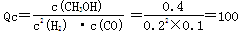 ,小于平衡常数160,故反应向正反应进行,即v正>v逆。
,小于平衡常数160,故反应向正反应进行,即v正>v逆。
③容器的体积缩小一半,压强增大,平衡向体积减小的方向移动,故平衡向正反应移动;平衡常数只受温度影响,与压强无关,温度不变,平衡常数不变。
(3)A、化学平衡常数说明可逆反应正向进行的程度,与反应进行的难易程度无关,故A错误;B、大气固氮的进行程度很小,利用大气固氮原理进行工业生成,产率很小,没有实际意义,故B正确;C、合成氨是放热反应,温度越低,有利于平衡向正反应移动,反应的转化率越高,反应越完全,故C正确;D、化学平衡常数说明可逆反应正向进行的程度,与反应速率无关,故D错误
考点:考查可逆反应速率、平衡常数的计算与应用以及外界条件对反应速率和平衡状态的影响等


科目:高中化学 来源: 题型:填空题
在温度为298K时,将0.10 mol无色的N2O4气体放入1L抽空的密闭容器中,出现红棕色,直至建立N2O4(g) 2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。
2NO2(g)的平衡。下图表示测定N2O4的浓度与时间关系的曲线(纵坐标为N2O4的浓度,横坐标为时间)。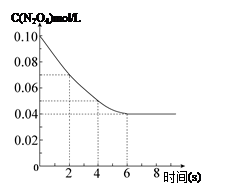
|
| T/K | 310 | 320 |
| K值 | 0.38 | 0.42 |
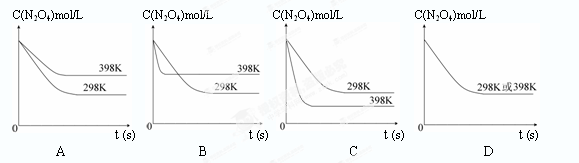
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
 CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气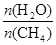 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示: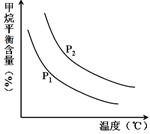
 CO2 (g)+H2(g) 获取。
CO2 (g)+H2(g) 获取。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):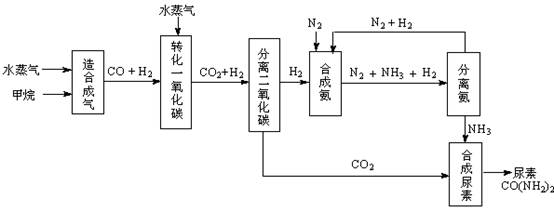
(1)“造合成气”发生的热化学方程式是CH4(g)+H2O(g) 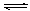 CO(g)+3H2(g);△H>0
CO(g)+3H2(g);△H>0
在恒温恒容的条件下,欲提高CH4的反应速率和转化率,下列措施可行的是 。
A、增大压强 B、升高温度 C、充入He气 D、增大水蒸气浓度
(2)“转化一氧化碳”发生的方程式是H2O(g) +CO(g) 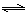 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则 m1 m2 ( 选填“<”、“=”、“>”)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) 。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=
(3)常温下,某纯碱溶液中滴入酚酞,溶液呈红色。说明该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论) 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上高纯硅可以通过下列反应制取:SiCl4(g)+ 2H2(g)  Si (s)+ 4HCl(g) -236kJ
Si (s)+ 4HCl(g) -236kJ
完成下列填空:
(1)在一定温度下进行上述反应,若反应容器的容积为2L,H2的平均反应速率为0.1mol/(L·min),3min后达到平衡,此时获得固体的质量 g。
(2)该反应的平衡常数表达式K= 。可以通过_______使K增大。
(3)一定条件下,在密闭恒容容器中,能表示上述反应一定达到化学平衡状态的是 。
a.2v逆(SiCl4)=v正(H2)
b.断开4molSi-Cl键的同时,生成4molH-Cl键
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
(4)若反应过程如图所示,纵坐标表示氢气、氯化氢的物质的量(mol),横坐标表示时间(min),若整个反应过程没有加入或提取各物质,则第1.5分钟改变的条件是______,第3分钟改变的条件是__________,各平衡态中氢气转化率最小的时间段是_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
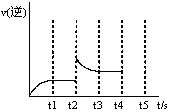
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列事实中,什么因素影响了化学反应的速率?
(1)黄铁矿煅烧时要粉碎成细小的矿粒:________;
(2)熔化的KClO 放出气泡很慢,加入少量MnO
放出气泡很慢,加入少量MnO 很快产生气体:________;
很快产生气体:________;
(3)同浓度、同体积的盐酸中放入大小相同的铁片和镁片产生气体有快有慢:________;
(4)同样大小的石灰石分别在0.1mol/L的盐酸和1mol/L的盐酸中反应速率不同:________________;
(5)夏天的食品易霉变,冬天就不易发生类似现象:________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)高铁酸钠(Na2FeO4)具有很强的氧化性,广泛应用于净水、电池工业等领域。以粗FeO(含有CuO、Al2O3和SiO2等杂质)制备高铁酸钠的生产流程如下,回答下列问题: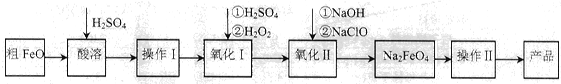
已知:NaClO不稳定,受热易分解。
(1)粗FeO酸溶过程中通入水蒸气(高温),其目的是__________________________。
(2)操作I目的是得到高纯度FeSO4溶液,则氧化I中反应的离子方程式为_________。
(3)本工艺中需要高浓度NaClO溶液,可用Cl2与NaOH溶液反应制备
①Cl2与NaOH溶液反应的离子方程式为_________________。
②在不同温度下进行该反应,反应相同一段时间后,测得生成NaClO浓度如下:
| 温度/℃ | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| NaClO浓度/mol·L-1 | 4.6 | 5.2 | 5.4 | 5.5 | 4.5 | 3.5 | 2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com