

分析 工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)分离难溶性固体和溶液采用过滤方法;进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有玻璃棒;
(2)滤渣I的主要成分为Cu(OH)2、Fe(OH)3,试剂乙的名称氨水;
(3)加入试剂甲的目的是将亚铁离子氧化为铁离子;
(4)废水处理流程中生成滤渣III的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-.
(6)根据题意消耗的m(Cr)=1000×1000×(104.5-0.5)=1.04×108mg=1.04×105g
则Cr的物质的量是$\frac{1.04×10{\;}^{5}g}{52g/mol}$=2×103mol,设Fe为xmol,根据14H++Cr2O72-+6Fe2+=6Fe3++2Cr3++7H2O反应方程式计算.
解答 解:工业废水中含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强,根据流程图知,工业废水中加入试剂甲后溶液中没有Fe2+,说明废水中的Fe2+被氧化生成Fe3+,甲应该具有强氧化性,且不能引进杂质,则试剂甲为双氧水;向溶液中加入过量NaOH溶液,Cu2+、Fe3+都转化为氢氧化物沉淀,根据题给信息(1)知,Al3+、Cr3+和过量NaOH反应生成可溶性的钠盐,然后采用过滤方法得到滤渣I、滤液I,滤渣I为Cu(OH)2、Fe(OH)3,滤液I中含有NaAlO2、NaCrO2、NaOH;向滤渣I中加入试剂乙,然后过滤,得到滤渣II和滤液II,根据题给信息(2)知,试剂乙为氨水,滤渣II为Fe(OH)3,滤液II为[Cu(NH3)4](OH)2;
向滤液I中加入试剂丙得到AlO2-和CrO42-,根据题给信息(1)知,试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,且不能引进杂质,所以试剂丙是氯气,向溶液中通入过量二氧化碳,得到沉淀IIIAl(OH)3 和滤液III,滤液III最终得到Na2Cr2O7;
(1)由操作流程图可知,操作Ⅰ是分离难溶性固体和液体的方法,故该操作名称为:过滤;操作I、II、III均是过滤的过程,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒,故答案为:过滤;玻璃棒;
(2)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,滤液是根据题意信息Cu(OH)2+4NH3•H2O=[Cu(NH3)4]2++2OH-+4H2O,所以试剂乙可以将氢氧化铜沉淀溶解掉,应为氨水,
故答案为:Cu(OH)2、Fe(OH)3;氨水;
(3)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+ Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,故答案为:将Fe2+氧化成Fe3+;
(4)向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,即2H2O+A1O2-+CO2=Al(OH)3↓+HCO3,
故答案为:2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-;
(5)用Fe为电极进行电解生成Fe2+,作为还原剂还原Cr2O72-,而铜电极作阳极生成Cu2+不能还原Cr2O72-,故不用Cu电极来代替Fe电极,故答案为:不能;因阳极产生的Cu2+不能使Cr2O72-还原到低价态;
(6)根据题意消耗的m(Cr)=1000×1000×(104.5-0.5)=1.04×108mg=1.04×105g
则Cr的物质的量是$\frac{1.04×10{\;}^{5}g}{52g/mol}$=2×103mol,设Fe为xmol.
14H++Cr2O72-+6Fe2+=6Fe3++2Cr3++7H2O
6 2
x 2×103mol
则$\frac{6}{x}$=$\frac{2}{2×10{\;}^{3}mol}$ 解得x=6×103mol,所以m(Fe)=n•M=336×103g=336kg,故答案为:336.
点评 本题是一道综合知识题目,涉及实验操作,氧化还原反应,电解池等,考查学生分析和解决问题的能力,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | CH4与P4的分子结构都是正四面体形,闪此在6.02×1023个CH4分子或P4分子中都含布4×6.02×1023个 共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si一O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去 0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通H2的一极是正极,通O2的一极是负极 | |
| B. | 通O2的一极是正极,通H2的一极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作时负极区附近pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
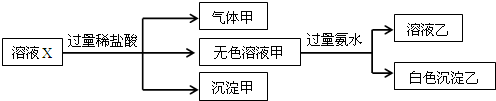
| A. | 气体甲一定是纯净物 | |
| B. | 沉淀甲是硅酸和硅酸铝的混合物 | |
| C. | 所有阴离子都可能存在于溶液X中 | |
| D. | 沉淀乙可能是Mg(OH)2和Al(OH)3的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X气体的相对分子质量比Y气体的相对分子质量大 | |
| B. | X可能是C2H4,Y可能是CH4 | |
| C. | X气体的密度小于Y气体的密度 | |
| D. | 充气后A气球质量比B气球质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 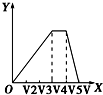 | B. | 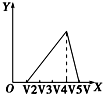 | C. | 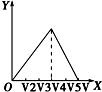 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将金粉和铁粉混合 | B. | 将牛奶加入水中混合 | ||
| C. | 蒸发食盐水制取食盐晶体 | D. | 用漏斗、滤纸过滤除去水中的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和Agl固体的悬浊液:c(Ag+)>c(Cl-)>(I-) | |
| C. | 25℃时,NH4Cl溶液的KN大于100℃时NaCl溶液的KN | |
| D. | 1g氢气燃烧生成液态水,放出的热量为142.9kJ.故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(I)△H=-285.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com