
| A. | Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| B. | 将过量SO2气体通入氨水中:SO2+NH3•H2O═NH4++HSO3- | |
| C. | 用醋酸除去水垢中的CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH- |
分析 A.漏掉铵根离子与氢氧根离子的反应;
B.二氧化硫过量,反应生成亚硫酸氢铵;
C.醋酸为弱酸应保留化学式;
D.不符合反应客观事实.
解答 解:A.Ba(OH)2溶液中滴加NH4HSO4溶液至Ba2+沉淀完全,离子方程式:Ba2++2OH-+NH4++H++SO42-=BaSO4↓+NH3•H2O+H2O,故A错误;
B.将过量SO2气体通入氨水中,二者反应生成亚硫酸氢铵:SO2+NH3•H2O═NH4++HSO3-,故B正确;
C.用食醋除去热水瓶中的水垢的离子反应为:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故C错误;
D.用KIO3氧化酸性溶液中的KI,离子方程式:5I-+IO3-+6H+=3I2+3H2O,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,为高考频考点,题目难度不大,熟悉反应的实质是解题关键,注意化学式的拆分、反应物用量对化学反应的影响,注意离子反应遵循客观事实.


科目:高中化学 来源: 题型:推断题


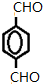 +4Ag(NH3)2OH$\stackrel{水浴}{→}$
+4Ag(NH3)2OH$\stackrel{水浴}{→}$ +4Ag↓+6NH3+2H2O.
+4Ag↓+6NH3+2H2O. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
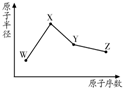 R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.
R、W、X、Y、Z是五种常见的短周期元素,其中四种元素的原子半径随原子序数变化如图所示.通常R的单质占空气体积的五分之四左右,W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强. ,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
,R的气态氢化物与其最高价氧化物的水化物反应生成一种化合物,该化合物的水溶液不呈中性的原因是NH4++H2O?NH3.H2O+H+(用离子方程式表示);
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).
利用空气催化氧化法制取联氨,其有关物质的转化如图所示(R1、R2代表烃基).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
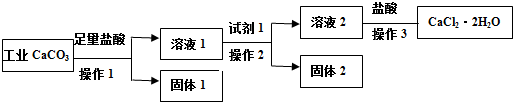
| A. | 试剂1可以是适量的氢氧化钙固体或适量的氧化钙固体 | |
| B. | 欲检验溶液2中是否含有Fe3+,可取少量溶液,滴加KSCN溶液,若溶液无明显现象,则不含有Fe3+ | |
| C. | 若用已知浓度AgNO3溶液来滴定产品(加入某指示剂)中的氯离子来测量产品纯度,计算所得的数据不可能大于100.0% | |
| D. | 若改变方案,在溶液2中加入适量的碳酸铵,得到的沉淀用盐酸溶解、酸化后进行操作3,可得到纯度更高的二水合氯化钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com