
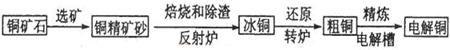
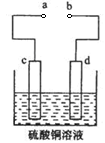
 2FeO+2SO2(缺少条件的扣1分)
2FeO+2SO2(缺少条件的扣1分) 2FeO+2SO2。
2FeO+2SO2。 2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。
2Cu2O+2SO2,根据化学方程式可得生成的氧化产物为SO2,物质的量为2/3mol。

科目:高中化学 来源:不详 题型:填空题
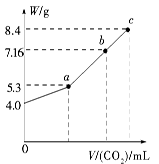
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
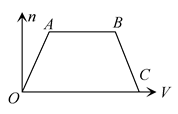
| A.②⑤ | B.⑤④⑥ | C.④② | D.④①⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
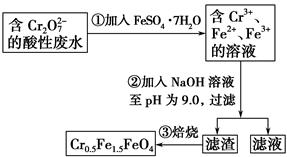
| A.操作①中反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O |
| B.操作②所得的滤渣成分主要为Fe(OH)3、Fe(OH)2、Cr(OH)3 |
| C.磁性材料Cr0.5Fe1.5FeO4中,显+3价铁与显+2价铁的质量之比为2∶3 |
| D.若废水中杂质不与绿矾反应,将该1 L废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4,理论上需加入绿矾13.9 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲酸甲酯的结构简式:CH2O |
B.Na+的.结构示意图: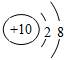 |
C.质子数为53、中子数为78的碘原子: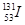 |
D.CO2的电子式为: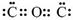 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com