
【题目】下列有关230Th和232Th的说法正确的是
A.230Th和232Th的核外电子数不同
B.230Th和232Th的化学性质不同
C.230Th和232Th互为同位素
D.230Th和232Th是同一种核素
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法中正确的是
A.常温常压下,16g CH4中含有的原子总数为5NA
B.78g苯含有碳碳双键的数目为3NA
C.1mol/L NaCl溶液中含有的氯离子数目为NA
D.标准状态下,11.2L CH3COOH中含有的分子数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族。F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 ,B、C、D三种元素的第一电离能从大到小的顺序为 。
(2)![]() 中B原子的杂化方式为 ,该离子的空间构型为________
中B原子的杂化方式为 ,该离子的空间构型为________
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式 ,化合物ABC中σ键和π键数目之比为 ,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 。
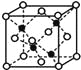
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为 ,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为 cm 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验某溶液中是否含有常见的四种无机离子,某化学小组的同学进行了如下所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得出的正确结论是( )

A.原溶液中一定含有SO42- B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl- D.原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________。
(3)第③步操作H2SO4需要适量,通常是通过_________来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________(填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现利用下图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。

(1)装置B中发生反应的化学方程式是:_______________________
(2)装置D中碱石灰的作用是________________
(3)停止反应,待B管冷却后,取其中的固体,加人过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________________________。
(4)为利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
①物质A可以是__________,作用是 ______________。
A.酸性高锰酸钾溶液
B.盐酸
C.硝酸
D.双氧水
E.氯气
② 中从FeCl3稀溶液到FeCl3·6H2O晶体的主要操作包括蒸发浓缩、降温结晶、过滤,该流程中需保持盐酸过量,主要原因是:(结合离子方程式简要说明)_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题:
(1)用离子方程式表示盐碱地(含较多Na2CO3)呈碱性的原因:____________;相同浓度的Na2CO3溶液与NaHCO3溶液等体积混合后,溶液中c(HCO3-) ____c(CO32-)(用“>、<、=”表示)。
(2)常温时,AlCl3溶液呈____性(填“酸”、“碱”或“中”),将AlCl3溶液蒸干,灼烧,得到的固体产物是________。AlCl3溶液和NaHCO3溶液混合时发生反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸钠在印染、造纸等众多行业中有着广泛的应用。研究小组用Na2CO3溶液吸收SO2制备Na2SO3。其实验流程如下:

(1)SO2对环境的危害主要是形成 。
(2)用Na2CO3溶液能吸收SO2的原因是 。
(3)查阅资料可知,向碳酸钠溶液通入二氧化硫的过程中发生如下反应:
①2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
②2NaHCO3+ SO2+H2O=2CO2↑+Na2SO3
③Na2SO3+ SO2+H2O=2NaHSO3
溶液中有关组分的质量分数变化如图是所示,图中的线2表示的组分为 (填化学式)。

(4)实验时,“反应II”中加入NaOH溶液的目的是 (用化学方程式表示)。
(5)获得的Na2SO3产品久置后质量变重,主要原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com