
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
分析 A、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
B、求出铵根离子的物质的量,然后根据铵根离子中含10个电子来分析;
C、求出碳酸钠的物质的量,然后根据碳酸钠中含1个碳酸根来分析;
D、气体单质有单原子分子、双原子分子和多原子分子.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁失去0.2NA个电子,故A错误;
B、1.8g铵根离子的物质的量为0.1mol,而铵根离子中含10个电子,故0.1mol铵根离子中含NA个电子,故B正确;
C、53g碳酸钠的物质的量为0.5mol,而碳酸钠中含1个碳酸根,故0.5mol碳酸钠中含0.5NA个,故C错误;
D、气体单质有单原子分子、双原子分子和多原子分子,故同温同压下,相同体积的任何体积的气体单质所含的原子个数不一定相同,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑧⑩ | B. | 除③外 | C. | 除④外 | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl溶液中无OH- | |
| B. | NaOH溶液中无H+ | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=c(H+)•c(OH-)=10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
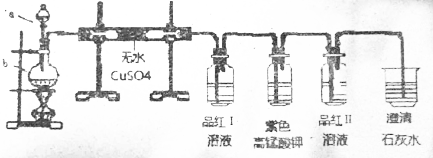
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
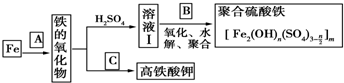
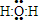 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com