
【题目】下列反应中,氧化反应与还原反应在同一元素间进行的是
A.Cl2 + 2NaOH = NaCl + NaClO + H2O
B.Fe + CuSO4 = FeSO4 + Cu
C.2KClO3 ![]() 2KCl + 3O2↑
2KCl + 3O2↑
D.2H2O ![]() 2H2↑+ O2↑
2H2↑+ O2↑
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某混合溶液中,可能大量含有的离子如下表:
阳离子 | H+、K+、Al3+、NH |
阴离子 | OH-、SO42—、CO32—、AlO2— |
将Na2O2逐渐加入上述混合溶液中并微热,产生沉淀和气体如图所示。

下列说法不正确的是:
A. 上述混合溶液中一定大量含有H+、NH4+、Al3+、Mg2+、SO42—
B. 图中a=4
C. b=7;c=9
D. 此溶液还需要用焰色反应继续检验,才能确定溶液准确组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】价电子式为4s24p1的元素,在周期表中的位置是( )
A. 第四周期第ⅠA族B. 第四周期第ⅢA族
C. 第五周期第ⅠA族D. 第五周期第ⅢA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。

请回答下列问题:
(1)物质A的化学式为____________________。
(2)写出单质B与强碱溶液反应的离子方程式_______________,氧化物D与NaOH溶液反应的化学方程式________________________________。
(3)溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式__________________________________。
(4)溶液E敞口放置容易变质,写出检验溶液E是否变质的实验操作、现象及结论__________,为了防止溶液E的变质,可往溶液中加入___________________。
(5)溶液I中所含金属离子是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。

(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为________________。
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为______________________。也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1 mol Br2时,转移的电子为________ mol。
(3)下列有关海水综合利用的说法错误的是____。
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用Ca(OH)2作为沉淀剂
D.海水提镁涉及到复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述中正确的是( )
A. 标准状况下,22.4 L SO3中含SO3分子数为NA
B. 46 g NO2中含有分子数为NA
C. 标况下22.4L Cl2与足量的NaOH溶液反应,转移的电子数为2NA
D. 标况下,足量的Fe与22.4L Cl2发生燃烧反应(Cl2完全反应),转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的量热计中,将100mL0.50mol/L CH3COOH溶液与100mL0.55mol/LNaOH溶液混合,温度从25.0℃升高到27.7℃。已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J·℃-1,生成溶液的比热容为4.184J·g-1·℃-1,两溶液的密度均近似为lg/mL.下列说法错误的是
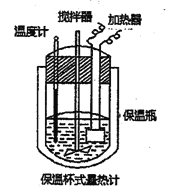
A. 若量热计的保温瓶绝热效果不好,则所测△H偏大
B. 该实验测得反应放出的热量为2665.7J
C. 该实验测得的中和热ΔH为-45.2kJ/mol
D. 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,硫化铜矿的湿法冶炼技术已经取得了很大的发展。现有一种催化氧化酸浸硫化铜矿的冶炼法,其工艺流程如图所示:

反应温度、固液比、反应时间、氯离子浓度都对铜的浸出率有较大的影响,下面是实验得出的这几种因素对铜的浸出率影响的变化曲线图(如图~如图所示)。

回答下列问题:
(1)火法炼铜的主要反应:①2CuFeS2+4O2![]() Cu2S+3SO2+2FeO(炉渣);
Cu2S+3SO2+2FeO(炉渣);
②2Cu2S+3O2![]() 2Cu2O+2SO2;③2Cu2O+Cu2S
2Cu2O+2SO2;③2Cu2O+Cu2S![]() 6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
6Cu+SO2↑;则在反应①、②、③中被氧化的元素为_______(填元素符号);若生成的SO2在标准状况下体积为4.48L,则发生转移的电子数目为________NA;由amolCuFeS2生成amolCu,共消耗________molO2。
(2)写出反应1的化学方程式:________________。经查,硫黄、FeSO4·7H2O均可入药,用途广泛,湿法炼铜与火法炼铜相比,优点是_____________________。
(3)从溶液中得到FeSO4·7H2O晶体的操作是_______________________________。
(4)根据实验以及工业生产的实验要求,从下表中得出的最佳工艺条件为________(填字母代号)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. 氨水中通入少量的SO2气体: SO2+ OH- == HSO3-
B. 氯气与水的反应: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 氯化钙溶液中通入CO2气体: Ca2++H2O+CO2== CaCO3↓+2H+
D. 二氧化锰跟浓盐酸共热制Cl2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com