
通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)。
SiC________Si;SiCl4________SiO2。
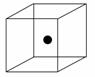
(2)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)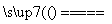 Si(s)+4HCl(g)
Si(s)+4HCl(g)
该反应的反应热ΔH=________kJ·mol-1。
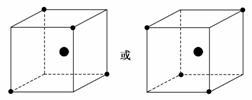
(1)> < (2)如下图
(3)236
解析 (1)SiC和晶体Si皆为原子晶体,由于碳化硅晶体中的Si—C键的键能大于硅晶体中Si—Si键的键能,故SiC的熔点比Si高;SiCl4为分子晶体,SiO2为原子晶体,故SiCl4的熔点比SiO2低。
(2)晶体硅的结构与金刚石相似,每个硅原子都被相邻的4个硅原子包围,这4个硅原子位于四面体的四个顶点上,被包围的硅原子处于正四面体的中心。(3)根据题目所给反应式,需要断裂的旧化学键键能之和为
4×360kJ·mol-1+2×436kJ·mol-1
=2312kJ·mol-1,形成的新化学键键能之和为
4×431kJ·mol-1+2×176kJ·mol-1
=2076kJ·mol-1,
所以ΔH=236kJ·mol-1。


科目:高中化学 来源: 题型:
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。试回答下列问题:
(1)钛有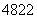 Ti和
Ti和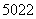 Ti两种原子,它们互称为______________。Ti元素基态原子的电子排布式为________________________。
Ti两种原子,它们互称为______________。Ti元素基态原子的电子排布式为________________________。
(2)如图是偏钛酸钡晶体的晶胞结构,可推知它的化学式为____________(用元素符号表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列性质判断,属于原子晶体的物质是( )
A.熔点2700℃,导电性好,延展性强
B.无色晶体,熔点3550℃,不导电,质硬,难溶于水和有机溶剂
C.无色晶体,能溶于水,质硬而脆,熔点为800℃,熔化时能导电
D.熔点-56.6℃,微溶于水,硬度小,固态或液态时不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
关于SiO2晶体的叙述正确的是(NA表示阿伏加德罗常数的数值)( )
A.通常状况下,60gSiO2晶体中含有的分子数为NA
B.60gSiO2晶体中含有2NA个Si—O键
C.晶体中与同一硅原子相连的4个氧原子处于同一四面体的4个顶点
D.SiO2晶体中含有1个硅原子,2个氧原子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属元素特征的叙述正确的是( )
A.金属元素的原子只有还原性,离子只有氧化性
B.金属元素一般在化合物中只显正价
C.金属元素在不同的化合物中的化合价均不同
D.金属元素的单质在常温下均为金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是( )
A.Na+(g)+Cl-(g)===NaCl(s) ΔH
B.Na(s)+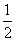 Cl2(g)===NaCl(s) ΔH1
Cl2(g)===NaCl(s) ΔH1
C.Na(s)===Na(g) ΔH2
D.Na(g)-e-===Na+(g) ΔH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com