
| A、铜在干燥的空气中和在潮湿的空气中存在的形态相同 |
| B、相同质量的铜分别与足量的氯气、硫完全反应,失去的电子数相同 |
| C、相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的量相同 |
| D、相同质量的铜分别与足量的稀硝酸、浓硝酸完全反应,生成气体的物质的量不同 |


科目:高中化学 来源: 题型:
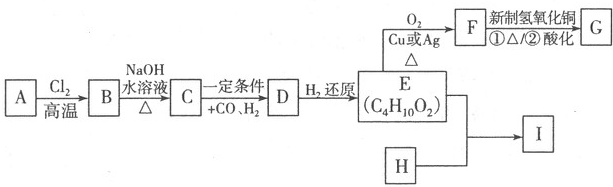
| Cl2 |
| 高温 |
| 一定条件 |
| +CO、H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
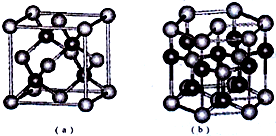 已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:
已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F2+离子核外各层电子均充满.请根据以上信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
A、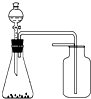 选择合适的试剂,装置可分别制取少量CO2、NO和O2 |
B、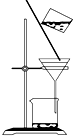 洗涤沉淀时(如图),向漏斗中加适量水,搅拌并滤干 |
| C、制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 |
| D、用广泛pH试纸测得0.10 mol?L-1 NH4Cl溶液的pH=5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去乙酸乙酯中的乙酸,可以用饱和的碳酸钠溶液 |
| B、配制溶液时,俯视刻度线来定容,会使得所配溶液浓度偏高 |
| C、用托盘天平称取8.7克食盐 |
| D、实验室可以用新制氢氧化铜悬浊液来检验甘油,观察到的现象是出现绛蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
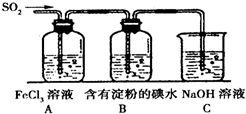 为探究SO2气体的还原性某兴趣小组设计了如装置图:
为探究SO2气体的还原性某兴趣小组设计了如装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 可经三步反应制取
可经三步反应制取  ,发生反应的类型依次是( )
,发生反应的类型依次是( )| A、水解反应、加成反应、氧化反应 |
| B、加成反应、水解反应、氧化反应 |
| C、水解反应、氧化反应、加成反应 |
| D、加成反应、氧化反应、水解反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com