
| A、H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ?mol-1 | ||
| B、CH4(g)+2O2(g)=2H2O(g)+CO2(g)△H=-802.3kJ?mol-1 | ||
C、CO(g)+
| ||
| D、2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ?mol-1 |
科目:高中化学 来源: 题型:
| A、将58.5 g NaCl溶解于1 L水中配成的溶液 |
| B、含K+为2 mol的K2SO4溶液 |
| C、将0.5 mol?L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 |
| D、将250 g 胆矾溶于水并配成1 L溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
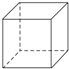
| A、它和苯的最简式相同 |
| B、它属于芳香烃 |
| C、它只有两种化学键 |
| D、它与苯乙烯(C6H5-CH═CH2)具有相同的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量使用燃煤发电是形成雾霾的主要原因 |
| B、天然气、煤气大量泄漏遇到明火会爆炸 |
| C、利用化学反应可实现12C到14C的转化 |
| D、晶体硅可用于光伏发电、制造芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNH3所含有的原子数为NA |
| B、常温常压下,22.4L氧气所含的原子数为2NA |
| C、常温常压下,48gO3所含的氧原子数为3NA |
| D、标准状况下,33.6LH2O含有9.03×1023个H2O分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、双原子分子中化学键键角越大,分子越稳定 |
| B、共价键都具有饱和性、方向性 |
| C、在分子中,两个成键的原子间的距离叫键长 |
| D、已知H-H键能为436 kJ?mol-1,H-N键能为391 kJ?mol-1,根据化学方程式N2(g)+3H2(g)═2NH3(g),△H=-92.4 kJ?mol-1,则N≡N键的键能是945.6 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物一定是碱性氧化物 |
| B、非金属氧化物一定是酸性氧化物 |
| C、只有在标准状况下,气体的摩尔体积才能为22.4L/mol |
| D、非电解质在水溶液中和熔融状态下均以分子形式存在,因而不能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
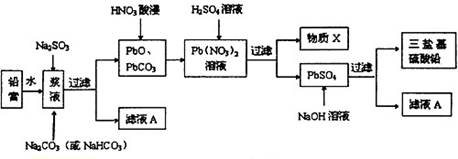
查看答案和解析>>
科目:高中化学 来源: 题型:
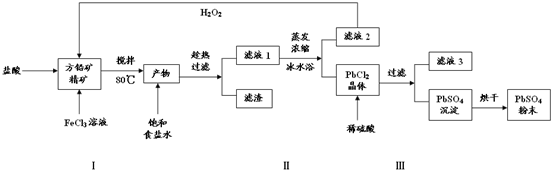
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com