
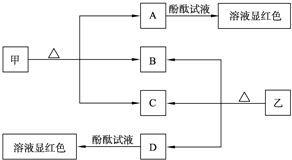
 HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O
HCO3-+OH-,所以加入酚酞后溶液显红色,故答案为:CO32-+H2O HCO3-+OH-;
HCO3-+OH-;

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
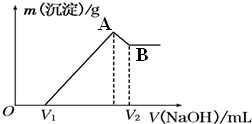 将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:
将0.1mol的镁铝混合物溶于100mL 4mol?L-1 HCl溶液中,然后滴加1mol?L-1的NaOH溶液.请回答:若在滴加NaOH溶液的过程中,沉淀质量(m)随加入NaOH溶液体积(V)的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60s |
| 褪色后,再滴入第2滴 | 15s |
| 褪色后,再滴入第3滴 | 3s |
| 褪色后,再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、用100 mL容量瓶配制90mL1mol/L的NaOH溶液 |
| C、用pH试纸测得新制氯水的pH为2 |
| D、用酸式滴定管准确量取10.00mLKMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述四种氧化物对应的水化物中,至少有三种是碱性氧化物 |
| B、将固体X加入氢氟酸中,X会溶解 |
| C、滤液Y中的阳离子只有Mg2+、Al3+、Fe3+三种 |
| D、滤液Y中加入过量氨水,所得沉淀为Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠能与酸反应生成盐和水,所以过氧化钠是碱性氧化物 |
| B、可用Na2O2除去N2中的水蒸气 |
| C、过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂 |
| D、过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
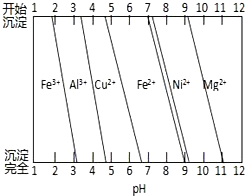 金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.
金属材料在人类生产生活中有着重要的应用,但人们使用更多的不是纯金属,而是合金.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com