
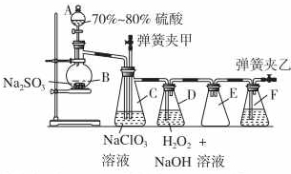
 装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)
装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4 (Ⅰ)分析 浓硫酸和Na2SO3制取SO2,装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4、装置D中发生反应:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,装置D有缓冲作用,可以作安全瓶,弹簧夹乙打开后,可以使装置F中的NaOH溶液吸收尾气;
(1)若装置气密性良好,水滴的速度会越来越慢,直到最后不滴;
弹簧夹乙打开后,可以使装置F中的NaOH溶液吸收尾气;
(2)装置E可起到安全瓶的作用,即防止液体倒吸入装置D中;
(3)检验碱液的存在可用酸碱指示剂;
(4)过量的SO2和过量的NaOH反应生成Na2SO3;Na2SO3与Ba(OH)2反应生成白色沉淀BaSO3.
解答 解:浓硫酸和Na2SO3制取SO2,装置C中发生反应:2NaClO3+SO2═2ClO2+Na2SO4、装置D中发生反应:2ClO2+H2O2+2NaOH═2NaClO2+2H2O+O2,装置D有缓冲作用,可以作安全瓶,弹簧夹乙打开后,可以使装置F中的NaOH溶液吸收尾气;
(1)若装置气密性良好,关闭两个弹簧夹,打开A中活塞,向A中注入水,水开始下滴,一段时间后,水不再下滴;
弹簧夹乙打开后,可以使装置F中的NaOH溶液吸收尾气,
故答案为:水开始下滴,一段时间后,水不再下滴;NaOH溶液;
(2)装置E可起到安全瓶的作用,即防止液体倒吸入装置D中;
故答案为:安全瓶(防止液体倒吸);
(3)氢氧化钠过量,溶液显碱性,能够使石蕊变蓝,能够使酚酞变红色;
故选:cd;
(4)一次实验制备中,通过检验发现制备的NaClO2中含有NaOH、Na2SO3,出现这些杂质的可能原因是:过量的SO2和过量的NaOH反应生成Na2SO3;
Na2SO3与Ba(OH)2反应生成白色沉淀BaSO3,所以选取试剂为Ba(OH)2溶液;
故答案为:制备的SO2和装置D中的NaOH同时过量;Ba(OH)2溶液.
点评 本题考查物质制备,为高频考点,涉及气体制备、氧化还原反应、基本操作、物质检验等知识点,明确实验原理、物质性质、基本原理是解本题关键,熟悉各个装置的作用及可能发生的反应,题目难度不大.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 | B. | 2.0 | C. | 13.0 | D. | 14.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
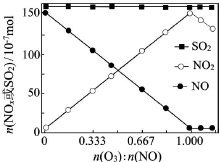 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的热化学方程式为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7 kJ/mol | |
| B. | N2H4(g)+$\frac{1}{2}$N2O4(g)═$\frac{3}{2}$N2(g)+2H2O(g)△H=-542.7 kJ/mol | |
| C. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7 kJ/mol | |
| D. | 2N2H4(g)+N2O4(g)═3N2(g)+4H2O(l)△H=-1059.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
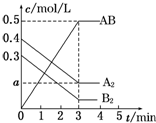 在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )
在一个容积为2L的密闭容器中,加入0.8mol A2气体和0.6mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)═2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.下列说法正确的是( )| A. | 图中a点的值为0.05 | B. | 该反应的平衡常数K=0.03 | ||
| C. | 平衡时A2的转化率为62.5% | D. | 温度升高,平衡常数K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 g碳完全燃烧时放出热量196.8 kJ | |
| B. | CO的燃烧热△H=-283.0 kJ/mol | |
| C. | H2的燃烧热△H=-241.8 kJ/mol | |
| D. | 制备水煤气的反应热△H=+131.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 尼古丁中C、H、N三种元素的质量比为5:7:1 | |
| B. | 吸烟有害健康 | |
| C. | CO比O2更易同血红蛋白结合,会导致人体缺氧 | |
| D. | 尼古丁中氮元素的质量分数约为17.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com