
����Ŀ��
���ڷ��ֵ�һ����Ȼ��ʮ����������������Al��Cu��Fe���ֽ���Ԫ����ɡ��ش��������⣺
��1������һ����ƽ�����������ϸ�����λ����Ķ��ؾ��壬��ͨ��_______________�������־��塢����ͷǾ��塣
��2����̬Feԭ����_________��δ�ɶԵ��ӣ�Fe3+�ĵ����Ų�ʽΪ_______________���������軯�ؼ���Fe3+���γɵ���������ɫΪ_______________��
��3�����Ƶ�Cu(OH)2�ɽ���ȩ��CH3CHO�����������ᣬ��������ԭ��Cu2O����ȩ��̼ԭ�ӵ��ӻ��������Ϊ____________����ȩ�����и�Ԫ�صĵ縺���ɴ�С��˳��Ϊ_______________������ķе����Ը�����ȩ������Ҫԭ����_____________________________��Cu2OΪ�뵼����ϣ��������������ڲ���4����ԭ�ӣ�������ԭ��λ�����ĺͶ��㣬��þ�������___________��ͭԭ�ӡ�
��4��Al����Ϊ�����������壬�侧������a��0.405nm����������ԭ�ӵ���λ��Ϊ__________����ʽ��ʾAl���ʵ��ܶ�_______________ g��cm-3��
���𰸡� X �������䷨ 4 1s22s22p63s23p63d5 ��[Ar] 3d5 Ѫ��ɫ sp3��sp2 O��C��H �����γ��˷��Ӽ���������ɷе����� 16 12 ![]()
��������(1)��������������ߣ�����X������ӷ��֣������X���߷������䣬�Ǿ��岻�������䣬������ڶ���֮�䣬���ͨ��������������ȷ�����ʴ�Ϊ��X�������䣻
(2)26��Ԫ��Fe��̬ԭ�Ӻ�������Ų�ʽΪ1s22s22p63s23p63d64s2����֪��3d�ϴ���4��δ�ɶԵ��ӣ�ʧȥ���ӱ�Ϊ������ʱ����ʧȥ4s�ϵ�2�����Ӻ�ʧȥ3d�ϵ�1�����ӣ����Fe3+�ĵ����Ų�ʽΪ1s22s22p63s23p63d5�����軯��ΪѪ��ɫ���ʴ�Ϊ��4��1s22s22p63s23p63d5��Ѫ��ɫ��
(3)��ȩ�м��ϵ�C�γ�4���Ҽ����µ��Ӷԣ���˲�ȡsp3�ӻ����ͣ�ȩ���е�C�γ�3���Ҽ���1���м����µ��Ӷԣ���ȡsp2�ӻ����ͣ�Ԫ�صķǽ�����Խǿ���縺����ֵԽ����ȩ�����и�Ԫ�صĵ縺���ɴ�С��˳��ΪO��C��H��������Ӽ���γ��������ȩ�����γ��������������ķе������ȩ���ʴ�Ϊ��sp3��sp2��O��C��H��������ڷ��Ӽ��������ɷе����ߣ�
(4)�þ�����Oԭ����Ϊ4��1+6��![]() +8��
+8��![]() =8����Cu2O��Cu��O�ı�����֪�þ�����ͭԭ����ΪOԭ������2������Ϊ16������Al�����һ��������������������������Alԭ����ͨ�������������������ϣ�����ռ
=8����Cu2O��Cu��O�ı�����֪�þ�����ͭԭ����ΪOԭ������2������Ϊ16������Al�����һ��������������������������Alԭ����ͨ�������������������ϣ�����ռ![]() ��ͨ��һ��������γ�8����������˸þ�������ԭ�ӵ���λ��Ϊ8��3��
��ͨ��һ��������γ�8����������˸þ�������ԭ�ӵ���λ��Ϊ8��3��![]() =12��һ��������Alԭ����Ϊ8��
=12��һ��������Alԭ����Ϊ8��![]() +6��
+6��![]() =4�����Al���ܶȦ�=
=4�����Al���ܶȦ�=![]() =
=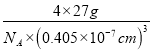 =
=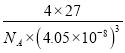 gcm-3���ʴ�Ϊ��16��12��
gcm-3���ʴ�Ϊ��16��12�� 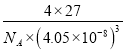 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.20molL��1��H2SO4��Һ�У�H+�����ʵ���Ũ��Ϊ��������
A. 0.10 molL��1 B. 0.20 molL��1 C. 0.40 molL��1 D. 0.50 molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
��������ˮ������һ��ʱ��pH��С
��Al��Fe�������������ܵ�����Ĥ�����ڲ����������ʴ
��Al2O3��Fe2O3��Ϊ������������Զ�����������
��pH��5.6��7.0֮��Ľ�ˮͨ����Ϊ����
A. �٢� B. �ڢ� C. �٢� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2017����]2016��IUPAC����117��Ԫ��ΪTs����������![]() ����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
����ti��n����Ts��ԭ�Ӻ���������������7������˵������ȷ����
A��Ts�ǵ������ڵ���A��Ԫ�� B��Ts��ͬλ��ԭ�Ӿ�����ͬ�ĵ�����
C��Ts��ͬ��Ԫ���зǽ��������� D��������Ϊ176��Ts���ط�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��(CH2=CH��COOH)�����ʿ����У� ��
�ټӳɷ�Ӧ��ȡ����Ӧ��������Ӧ���кͷ�Ӧ��������Ӧ
A.�٢�B.�٢ۢ�C.�٢ۢܢ�D.�٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������BN����һ����Ҫ�Ĺ����մɲ�������Ȼ��ɰΪ��ʼ�����һϵ�з�Ӧ���Եõ�BF3��BN������ͼ��ʾ��

��ش��������⣺
��1��д��B2O3��NH3��Ӧ����BN�ķ���ʽ___________________________
��2����̬Nԭ�ӵļ۲�����Ų�ʽΪ_________��
��3��B��N��O��ȣ���һ������������_______��BN��BԪ�صĻ��ϼ�Ϊ_____
��4��SO42�C��Sԭ�ӵ��ӻ��������Ϊ_______��O��S��O�ļ�����_______��д��һ����SO42�C�ȵ��������_______��
��5��BF3����NH3��Ӧ����BF3NH3��BF3���ӵķ��ӹ���Ϊ_______��BF3NH3��BF3��NH3֮��ͨ��___________������Ӽ������� ��λ������������� ��ϡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ�IJ����Ǻ���һ������ʯ�ͻ�����չˮƽ����Ҫ��־֮һ������˵����ȷ����(����)
A. ��ϩ�����Ҵ�����������Ӧ
B. ��ϩ��ʹ����KMnO4��Һ��ɫ
C. һ����������ϩ�ɷ����ۺϷ�Ӧ
D. һ����������ϩ�ɷ����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������������ȫȼ����������������(����)
A.CH4B.C2H6C.C3H8D.C6H14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�����౦�����Ȼ��Դ����ͼ��ij�����Ժ�ˮ��Դ�ۺ����õIJ�������ʾ��ͼ��


��1�����оٺ�ˮ���������ַ���__________��__________��
��2�����Ƶ�ʳ��ˮͨ�����ӽ���Ĥ���۵�⡣��ͼΪ���ӽ���Ĥ�����ԭ��ʾ��ͼ����ⱥ��ʳ��ˮ�����ӷ���ʽΪ______________________���Ը��ݵ缫��Ӧ����������Ĥ������X��__________��
��3����֪[Ca(OH)2=5.5��l0-6��Mg(OH)2=1.8��l0-11]����c(Mg2-)=3.6��l0-3mol/L �� MgCl2��Һ�� cmol/L��NaOH��Һ�������ϣ�Ҫʹ���Һ����Mg(OH)2������c���ٵ���__________mol/L������������õ�Mg(OH)2�����г�����Ca(OH)2��������ȥ��д����ķ�����_____________________________��
��4����ҵ��ȡþ������MgCO3�����ȷֽ⣬�ʶ����ӽ�̿�����Ȼ��õ�MgCl2�����ͨ�����MgCl2��ȡMg��д���÷��ʶ����Ļ�ѧ����ʽ__________________________________________����������Ȼ�þ���õ�þ������ȴ��Ϊ����þ�����������У�þ�������������Χ����ȴ����__________��ѡ������ĸ����
A��Cl2 B��N2 C��H2 D������
��5����ͬѧ��Ϊ������ۺ�ɼ���Mg(OH)2�����õ�MgO���ٵ�����ڵ�MgO�ƽ���þ�������ɼ�ʵ�鲽�裬����ʵ��ļ�Լ��ԭ���Ҳ�ͬ��Ĺ۵㣬����������__________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com