
| A、14C与12C互为同素异形体 |
| B、乙醇、乙酸和甲醛广泛应用于食品加工 |
| C、纤维素、合成纤维、光导纤维都是有机高分子化合物 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
| A、离子半径:丙>丁>乙 |
| B、单质的还原性:丁>丙>甲 |
| C、甲、乙、丙的氧化物均只有一种 |
| D、乙、丙、丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
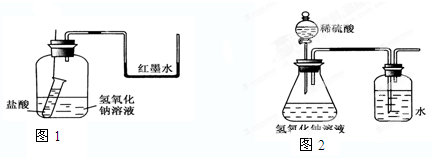
| 编号 | 盐酸 | 氢氧化钠 | △t/℃ |
| 1 | 0.1mol?L-1 | 0.05mol?L-1 | 3.5 |
| 2 | 0.1mol?L-1 | 0.1mol?L-1 | x |
| 3 | 0.2mol?L-1 | 0.2mol?L-1 | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.05mol/L |
| B、0.001mol/L |
| C、0.002mol/L |
| D、0.005mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、CaCO3与醋酸(CH3COOH)反应:CaCO3+2H+=Ca2++CO2↑+H2O |
| C、向Fe2O3溶液中通入HI:Fe2O3+6H+=2Fe3++3H2O |
| D、MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验编号 | T(℃) | N(CO)/nH2 | P(Mpa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠溶液和稀硫酸 |
| B、氯化铝溶液和氢氧化钠溶液 |
| C、四羟基合铝酸钠溶液和稀盐酸 |
| D、氯化钡溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
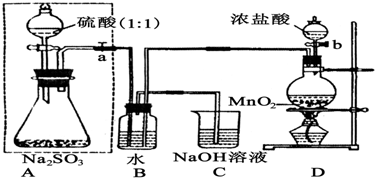
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | ||
| 起始物质的量 | n(SO2)/mol | 0.4 | 0.8 | 0.8 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | |
| SO2的平衡转化率/% | 80 | α1 | α2 | |
| A、乙中SO2的平衡转化率大于80% |
| B、该温度下,乙达平衡时间小于甲 |
| C、平衡时,丙中c(SO3)是甲中的2倍 |
| D、平衡时,甲中O2的转化率大于乙中O2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com