
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是
| 选项 | 操作及现象 | 溶液 |
| A | 通人CO2,溶液变浑浊。再升温至65℃以上,溶液变澄清。 | C6H5ONa溶液 |
| B | 通人CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 | Na2SiO3溶液 |
| C | 通人CO2,溶液变浑浊。再加人品红溶液,红色褪去。 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。再加入足量NaOH溶液,又变浑浊。 | Ca(OH)2溶液 |
科目:高中化学 来源: 题型:
下列有关物质的性质和该性质的应用均正确的是
A.常温下浓硫酸能是铝发生钝化,可在常温下用铝制贮藏贮运浓硫酸
B.二氧化硅不与任何酸反应,可用石英制造耐酸容器
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气中NOx是NO和NO2的混合物(不含N2O4)。
(1)根据废气排放标准,1 m3烟气最高允许含400 mg NOx。若NOx中NO质量分数为0.85,则1 m3烟气中最高允许含NO___________________L(标准状况,保留2位小数)。
(2)工业上通常用溶质质量分数为0.150的Na2CO3水溶液(密度1.16 g·mL-1)作为NOx吸收剂,则碳酸钠溶液物质的量浓度为__________________________mol·L-1(保留2位小数)。
(3)已知:NO+NO2+Na2CO3 2NaNO2+CO2①
2NaNO2+CO2①
2NO2+Na2CO3 NaNO2+NaNO3+CO2②
NaNO2+NaNO3+CO2②
1 m3含2 000 mg NOx的烟气用质量分数为0.150的碳酸钠溶液吸收。若吸收率为80%,吸收后的烟气_______________排放标准(填“符合”或“不符合”),理由:_________________。
(4)加入硝酸可改变烟气中NO和NO2的比,反应为:NO+2HNO3 3NO2+H2O
3NO2+H2O
当烟气中n(NO)∶n(NO2)=2∶3时,吸收率最高。
1 m3烟气含2 000 mg NOx,其中n(NO)∶n(NO2)=9∶1。
计算:(ⅰ)为了达到最高吸收率,1 m3烟气需用硝酸的物质的量(保留3位小数)。
(ⅱ)1 m3烟气达到最高吸收率90%时,吸收后生成NaNO2的质量(假设上述吸收反应中,反应①比反应②迅速。计算结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是( )
A.NaCl、NaClO B.NaCl、NaClO3
C.NaClO、NaClO3 D.NaClO3、NaClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料。
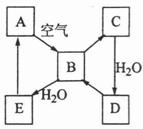
(1)写出A在加热条件下与H2反应的化学方程式
(2)写出E与A的氢化物反应生成A的化学方程式
(3)写出一个由D生成B的化学方程式 ;
(4)将5mL0.10mol·L-1的E溶液与10mL0.10mol·L-1的NaOH溶液混合。
①写出反应的离子方程式 ;
②反应后溶液的pH 7(填“大于”、“小于”或“等于”),理由是 ;
③加热反应后的溶液,其pH (填 “增大”、“不变”或“减小”),理由是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的工业原料。工业上利用反应式在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是
A 若管道漏气遇氨就会产生白烟
B 该反应利用了Cl2的强氧化性
C 该反应属于复分解反应 
D 生成1molN2有6mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关工业生产的叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室生产的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
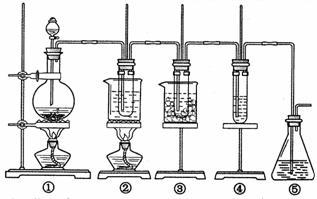
图中:①为氯气发生装置;②的试管里盛有15mL30%KOH 溶液.并置于水浴中; ③ 的试管里盛有15mL 8 % NaOH 溶液.并置于冰水浴中; ④ 的试管里加有紫色石蕊试液; ⑤ 为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰.通过________________(填写仪器名称)向烧瓶中加人适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在① 与② 之间安装盛有___________(填写下列编号字母)的净化装置。
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_______________________________
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是________(填写编号字母);从②的试管中分离出该晶体的方法是________________(填写实验操作名称)

(3)本实验中制取次氯酸钠的离子方程式是:_____________________________
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为____色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________________________ |
| 然后溶液从无色逐渐变为____色 | _______________________________________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各溶液中,Na+物质的量浓度最大的是( )
|
| A. | 2L 0.5mol/L NaCl溶液 | B. | 3L 0.3mol/L Na2SO4溶液 |
|
| C. | 1L 0.4mol/L Na2CO3溶液 | D. | 4L 0.15mol/L Na3PO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com