
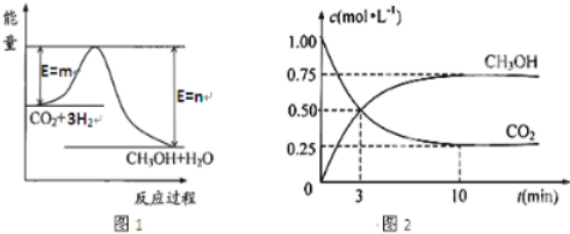
分析 (1)图象分析可知反应物能量高于生成物反应为放热反应;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)由图2可知,甲醇的浓度变化量为0.75mol/L,根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2),相同条件下气体压强之比等于气体物质的量之比;
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极是甲醇失电子在酸性溶液中生成二氧化碳,结合电荷守恒和原子守恒配平书写得到的电极反应式
解答 解:(1)图象分析可知反应物二氧化碳和氢气总你高于生成物甲醇和水蒸气的总能量,反应为放热反应,
故答案为:放热; 反应物的总能量高于生成物的总能量;
(2)CO2(g)+3H2(g)?CH3OH(g)+H2O(g),为气体体积减小的放热反应
A.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v (H2)=3v(CO2)不能说明正逆反应速率相同,不能证明反应达到平衡状态,故A错误;
B.反应前后气体物质的量发生变化,当容器内气体压强保持不变说明反应达到平衡状态,故B正确;
C.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v逆(CO2)=v正(CH3OH),说明二氧化碳正逆反应速率相同,故C正确;
D.反应前后气体体积和质量不变,密度始终不变,容器内气体密度保持不变不能说明反应达到平衡状态,故D错误;
故答案为:BC;
(3)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L•min),速率之比等于化学计量数之比,所以v(H2)=3v(CH3OH)=3×0.075mol/(L•min)=0.225mol/(L•min),反应前后气体压强之比等于其物质的量之比,反应前气体物质的量=4mol,依据三行计算列式得到;,甲醇生成0.75mol,最后达到平衡状态二氧化碳物质的量0.25mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
达平衡时容器内平衡时与起始时的压强之比=(0.25+0.75+0.75+0.75):(1+3)=5:8,
故答案为:0.225mol/(L.min);5:8;
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极是甲醇失电子在酸性溶液中生成二氧化碳,结合电荷守恒和原子守恒配平书写得到的电极反应式为CH3 OH-6e-+H2O=6H++CO2,
故答案为:CH3 OH-6e-+H2O=6H++CO2;
点评 本题考查了化学图象分析、化学平衡状态的判断、反应速率概念计算、原电池电解反应书写等知识点,掌握基础是解题关键,题目难度中等


科目:高中化学 来源:2017届河北省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列关于自然界中氮循环示意图(如图)的说法错误的是( )

A.氮元素只被氧化
B.豆科植物根瘤菌固氮属于自然固氮
C.其它元素也参与了氮循环
D.含氮无机物和含氮有机物可相互转化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一上第一次月考化学卷(解析版) 题型:选择题
同温同压下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.SO2
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上第一次月考化学卷(解析版) 题型:选择题
化学与生产、生活密切相关,下列说法正确的是
A.淀粉、纤维素都属天然高分子化合物
B.食品包装袋中可用碱石灰做干燥剂
C.煤经过液化等物理变化可转化为清洁燃料
D.制作航天服的聚醋纤维属新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1-a-b-c)mol | B. | (1+a+2b+3c) mol | C. | (2a+3b+4c)mol | D. | (a+b+c)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属腐蚀就是金属失去电子被还原的过程 | |
| B. | 水库中的水闸(钢板)与外加直流电源正极相连,可防止水闸被腐蚀 | |
| C. | 镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 | |
| D. | 钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-=Fe3+,继而形成铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焦炭在高温下与水蒸气的反应是吸热反应 | |
| B. | 氢氧化钾与硝酸的反应是放热反应 | |
| C. | 燃料有足够的空气就能充分燃烧 | |
| D. | 化学反应一定伴随着能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子化热由大到小:Na>Mg>Al | |
| B. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| C. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| D. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com