
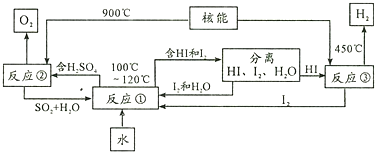
分析 (1)根据盖斯定律,由①+②+③可得;
(2)根据反应①②写出反应化学方程式,根据制备氢气的过程使用的物质、能量的消耗、环境的污染污染等方面进行分析.
解答 解:(1)①3FeCl2+4H2O$\frac{\underline{\;500℃\;}}{\;}$Fe3O4+6HCl+H2;
②Fe3O4+$\frac{3}{2}$Cl2+6HCl$\frac{\underline{\;100℃\;}}{\;}$3FeCl3+3H2O+$\frac{1}{2}$O2;
③3FeCl3$\frac{\underline{\;300℃\;}}{\;}$3FeCl2+$\frac{3}{2}$Cl2↑
根据盖斯定律,由①+②+③可得:H2O$\frac{\underline{\;△\;}}{\;}$$\frac{1}{2}$O2+H2,氧气具有助燃性,而氢气具有可燃性,则主要用来生产能解决环境和能源问题的某种气体为H2;
故答案为:H2;
(2)由制备氢气的过程可知,反应①发生的反应是:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$H2SO4+2HI,反应②是H2SO4分解为了SO2、O2和H2O,故发生的反应为:2H2SO4═2SO2↑+O2↑+2H2O,用该法制取氢气最大的优点是:SO2和I2循环使用,避免了污染环境;
故答为:SO2+I2+2H2O$\frac{\underline{\;100-120℃\;}}{\;}$H2SO4+2HI;2H2SO4═2SO2↑+O2↑+2H2O;SO2和I2循环使用,避免了污染环境.
点评 本题主要考查盖斯定律的应用和新能源的利用,把握已知反应和流程图为解答的关键,侧重分析与迁移应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S属于非电解质 | B. | NO和CO都属于酸性氧化物 | ||
| C. | H2S只有还原性没有氧化性 | D. | H2S、NO和CO都能与臭氧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,0.05NA个CO2分子所占的体积是1.12L | |
| B. | 1mol 氧气所含有的原子数为NA | |
| C. | 常温常压下,32g O2和34g H2S气体分子个数比为1:1 | |
| D. | 11.2L NH3中所含的质子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
步骤1:取少量沉淀于试管中,加入足量0.1 mol•L-1 HCl . | 沉淀全部溶解,有气泡产生,说明沉淀中有CaCO3 |
步骤2:往步骤1的剩余物中,再滴加几滴0.01 mol•L-1 KMnO4 . | 溶液紫红色褪去,说明沉淀中有CaC2O4,结合步骤1,假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
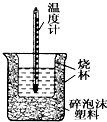 50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.05mol•L-1盐酸与50mL0.55mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com