
甲醇既是重要的化工原料,又是电动公交车的清洁能源,利用水煤气在一定条件下含成甲醇,发生的反应为:CO (g) +2H2(g) CH3OH(l) △H=?
CH3OH(l) △H=?
(1)己知CO、H2、CH3OH的燃烧热分别为283.0kJ/mol,285.8kJ/mol,726.5kJ/mol 则△H=______。
(2)在一容积为2L的恒容密闭容器中加入0.2mol CO和0.4mol H2,发生如下反应:CO (g) +2H2(g) CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
CH3OH(g),实验测得T1℃和T2℃下,甲醇的物质的量随时间的变化如下表所示,下列说法正确的是
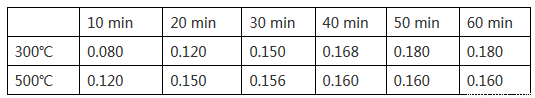
①由上述数据可以判断:T1℃_____T2℃
②T1℃时,0~20minH2的平均反应速率v(H2)=_________。
③该反应T1℃达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.改用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲醇 E.增加CO的浓度
(3)若保持T1℃不变,起始时加入CO、H2、CH3OH的物质的量分别为amol、bmol、cmol,达到平衡时,仍与原平衡等效,则a、b、c应该满足的条件___________。
(4)当反应在T1℃达到20min时,控制体积不变,迅速将0.02molCO,0.04molH2,0.18molCH3OH同时投入体系中,后在恒压条件下,反应在40min时达到平衡,请在图中画出20〜40min内容器中 H2浓度的变化趋势曲线:___________
(5)在以CH3OH(l)为燃料的燃料电池中,电解质溶液为酸性,则负极的电极反应式为__________;理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______。(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届新疆乌鲁木齐地区高三第二次诊断性测验化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A. Na2S溶液中:SO42-、K+、Cl-、Cu2+
B.  的溶液:K+、AlO2-、CO32-、Na+
的溶液:K+、AlO2-、CO32-、Na+
C. 饱和氯水中:Cl-、NO3-、Na+、SO32-
D. 碳酸氢钠溶液:K+、SO42-、Cl-、H+
查看答案和解析>>
科目:高中化学 来源:广西南宁市2017届高三第一次模拟测试理综化学试卷 题型:填空题
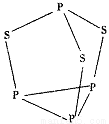
化学一物质结构与性质三硫化四磷是黄绿色针状结晶,其结构如图所示,不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机溶剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:
(1)Se是S的下一周期同主族元素,其核外电子排布式为_________;
(2)第一电离能:S_________(填“>”“<”或“=”,下同)P;电负性:S_________P。
(3)三硫化四磷分子中P原子采取_________杂化,与PO3-互为等电子体的化合物分子的化学式为_________。
(4)二硫化碳属于_________ (填“极性”或“非极性”)分子。
(5)用NA表示阿伏加德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为_________。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8 K,主要原因是_________。
(7)氢氧化钠具有NaCl型结构,其晶饱中Na+与OH-之间的距离为acm,晶胞中Na+的配位数为_________,用NA表示阿伏加德罗常数的数值,NaOH的密度为_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.若反应X+Y===M是放热反应,该反应一定不用加热
B.需要加热方能发生的反应一定是吸热反应
C.CO2与CaO化合是放热反应,则CaCO3分解是吸热反应
D.1 mol硫酸与足量氢氧化钠发生中和反应生成水所释放的能量称为中和热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师范大学附属中学高一3月月考化学试卷(解析版) 题型:选择题
已知X+、Y2+、Z—、W2—四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A. 原子序数:Y>X>Z>W
B. 离子半径:X>Y>Z>W
C. 原子最外层电子数:Z>W>Y>X
D. 还原性:X>Y,W2—>Z—
查看答案和解析>>
科目:高中化学 来源:2017届河北省石家庄市高三下学期模拟联考理科综合化学试卷(解析版) 题型:选择题
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5,用该电池电解100mL 硫酸铜溶液,实验装置如图所示(b、c均为惰性电极),当外电路中通过0.02mol电子时,B装置两极共收集到0.224L气体(标准状况)。下列说法正确的是( )
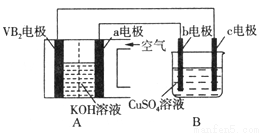
A. 电解过程中,b电极表面先有红色物质析出,然后有气泡产生
B. VB2为负极,电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+
C. 电池内部OH-移向a电极,溶液pH保持增大
D. 忽略溶液体积变化,电解后B装置中溶液的pH为1
查看答案和解析>>
科目:高中化学 来源:2017届福建省厦门市高三下学期第一次质量检测理综化学试卷(解析版) 题型:简答题
一种通过铁基氧载体(Fe3O4/FeO)深度还原和再生来合成二甲醚(CH3OCH3)的原理如下图:
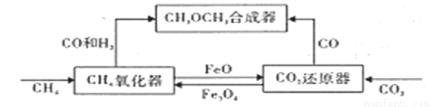
(1)二甲醚的合成反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g) ΔH1
CH3OCH3(g)+CO2(g) ΔH1
①已知CO、H2与CH3OCH的燃烧热(ΔH)分别为a kJ·mol-1、b kJ·mol-1、c kJ·mol-1、(a、b、c均小于0),则ΔH1=________kJ·mol-1。
②该反应选用CuO/ZnO/Al2O3复合催化剂,该催化剂能_______(填标号)。
A.促进平衡正向移动 B.提高反应速率
C.降低反应的活化能 D.改变反应的焓变
(2)CH4氧化器中发生的主反应:
ⅰ. CH4(g)+Fe3O4(s) CO(g)+2H2(g)+3Fe(s)
CO(g)+2H2(g)+3Fe(s)
ⅱ. CH4(g)+4Fe3O4(s) CO2(g)+2H2O(g)+12FeO(s)
CO2(g)+2H2O(g)+12FeO(s)
850℃时,压强和部分气体体积分数、固相各组分质量分数的关系如右下图。
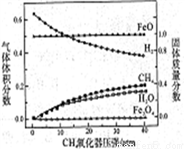
①随着压强的增大,反应ⅰ的平衡常数K值________(填“增大”、“减小”、 或“不变”)
②结合图像,分析H2O的体积分数变化的原因_________(用化学方程式表示)
(3)将一定量的FeO和CO2置于CO2还原器(体积不变的密闭容器)中,发生的主反应:
CO2(g)+3FeO(s) Fe3O4(s)+ CO (g) ΔH2
Fe3O4(s)+ CO (g) ΔH2
保持其他条件不变,测得不同温度下最终反应体系中CO、CO2体积分数如下表:
温度I/℃ | 100 | 170 | 200 | 300 | 400 | 500 |
CO2体积分数 | 0.67 | 0.67 | 0.75 | 0.82 | 0.9 | 0.92 |
CO体积分数 | 0.33 | 0.33 | 0.25 | 0.18 | 0.1 | 0.08 |
①ΔH2_______0(填“>”或“<”)。
②若在150℃时进行上述转化,理论转化率ɑ(FeO)=___________。
③在上述反应体系中,一定可以说明该反应达到平衡状态的是______(填标号)。
A.体系的压强不变 B.CO2的物质的量不变
C.CO的生成速率和消耗速率相等且不等于零 D.气体的平均摩尔质量不变
④根据化学反应原理,分析CO2还原器温度设置在170℃的原因___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都简阳市高二上学期期末检测化学试卷(解析版) 题型:选择题
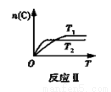
某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g) cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
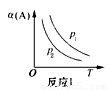
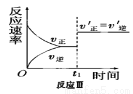
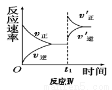
A.反应I:若p1>p2,则此反应只能在高温下自发进行
B. 反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源:山东省2016-2017学年高一3月月考化学试卷 题型:选择题
下列物质的用途错误的是
A. 硅是制造太阳能电池的常用材料 B. 硅是制取水泥的原料
C. 水玻璃可用作木材防火剂 D. 二氧化硅是制造光导纤维的材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com