
高铁电池是一种新型可充电电池,该电池长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是()
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是()
A. 放电时负极反应为:Zn﹣2e﹣+2OH﹣=Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3﹣3e﹣+5OH﹣=FeO42﹣+4H2O
C. 放电时每转移1 mol电子,正极有1mol K2FeO4被还原
D. 放电时正极附近溶液的pH值升高
考点: 原电池和电解池的工作原理.
分析: 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH﹣=FeO42+4H2O+3e﹣,阳极消耗OH﹣离子,碱性要减弱.
解答: 解:A、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn﹣2e﹣+2OH﹣=Zn(OH)2,故A正确;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3﹣3e﹣+5OH﹣ FeO42﹣+4H2O,故B正确;
FeO42﹣+4H2O,故B正确;
C、放电时正极反应为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣,每转移3mol电子,正极有1molK2FeO4被还原,故C错误;
D、放电时正极反应为FeO42+4H2O+3e﹣=Fe(OH)3+5OH﹣,生成氢氧根离子,碱性要增强,故D正确.
故选C.
点评: 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


科目:高中化学 来源: 题型:
传统合成氨工业需要采用高温、高压和催化剂.近来美国化学家使用新型铁系催化剂,在常温下合成了氨气.下列说法正确的是()
A. 新型合成氨方法是吸热反应
B. 新型合成氨方法可简化生产设备
C. 新型催化剂提高了N2和H2的转化率
D. 两种方法中该反应的化学平衡常数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的饱和石灰水中加入少量CaO固体,恢复到原来温度时,下列说法正确的是( )
|
| A. | 溶液中的Ca2+总数不变 | B. | 溶液中 OH﹣数目增加 |
|
| C. | 溶质的物质的量浓度不变 | D. | 溶液的质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4•5H2O(s)═CuSO4(s)+5H2O(l)△H=+Q2 kJ•mol﹣1则Q1、Q2的关系为()
A. Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
含11.2g KOH的稀溶液与1L 0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是()
A. KOH(aq)+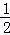 H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
H2SO4(aq)=1/2K2SO4(aq)+H2O (l);△H=﹣11.46kJ/mol
B. 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O (l);△H=﹣114.6kJ/mol
C. 2KOH(aq)+H2SO4=K2SO4(aq)+H2O (l);△H=+114.6kJ/mol
D. KOH (aq)+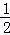 H2SO4(aq)=
H2SO4(aq)=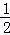 K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
K2SO4(aq)+H2O (l);△H=﹣57.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列几种化学键的键能:
化学键 Si﹣Si键 H﹣H键 Cl﹣Cl键 H﹣Cl键 Si﹣Cl键
键能(KJ/mol) 176 436 243 431 360
请计算下列反应的反应热:
(1)H2(g)+Cl2(g)=2HCl(g)△H= ;
(2)50mL 0.50mol•L﹣1盐酸与50mL 0.55mol/L NaOH溶液简易量热计中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(a)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”).
(b)酸、碱混合时,把量筒中的NaOH溶液缓缓倒入小烧杯中测得的中和热的数值会 .(填“偏大”“偏小”“无影响”)
(c) 实验中用环形铜丝搅拌棒代替 ,测得的中和热的数值会 .(均填“偏大”“偏小”“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铝、硫酸钾和明矾的混合溶液中,SO42﹣的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解.则反应后溶液中K+的浓度约为( )
|
| A. | 0.225mol/L | B. | 0.25mol/L | C. | 0.45mol/L | D. | 0.9mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物甲经氧化得到乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2);由此推断甲的结构简式为( )
|
| A. | ClCH2CH2OH | B. | OHC﹣O﹣CH2Cl | C. | ClCH2CHO | D. | HOCH2CH2OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com