
CN-为拟卤素离子,(CN)2性质和卤素类似。下列叙述错误的是
A.(CN)2可以和H2反应 B.(CN)2不能和碱反应 C.CN-具有还原性 D.(CN)2的性质活泼
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
X、Y均为短周期元素,X位于IA族,X、Y能形成X2Y化合物,下列说法正确的是
A.X与Y形成的化合物中原子个数比可能为1:1
B.X2Y不可能是共价化合物
C.X和Y分别形成的简单离子不可能具有相同电子层结构
D.根据周期表递变规律判断X原子半径一定大于Y原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为CO(g)+ H2O(g) 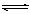 CO2(g) + H2(g) ; △H <0反应达到平衡后,为提高CO的转化率,下列措施中正确的是 ()
CO2(g) + H2(g) ; △H <0反应达到平衡后,为提高CO的转化率,下列措施中正确的是 ()
A 增加压强 B 降低温度 C 增大H2O(g) 的浓度 D 更换催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
用光洁的铂丝蘸取某无色溶液,在无色灯焰中灼烧时,观察到黄色火焰,下列有关叙述中正确的是
A.只有Na+ B.一定含Na+,也可能含K +
C.既有Na+ 又有K+ D.可能含Na+,也可能含K +
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| A | B | C | D | |
| Y | CO2 | Fe3O4 | CuCl2 | FeCl3 |
| W | MgO | Al2O3 | FeCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组设计如下图实验装置进行实验。
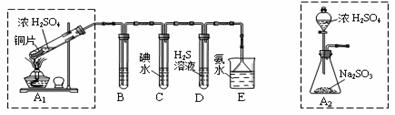
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,
C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(3)氨水吸收过量SO2的反应的离子方程式为 。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、lmol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊, 则“吸收液”中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用,下列说法不正确的是( )
A氧化镁用作耐火材料
B.Na2O常用于潜水艇或呼吸面具的供氧剂
C.明矾溶于水形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
D.FeCl3溶液可用于刻制印刷铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液中能大量共存的一组离子是( )
A.Na+、Mg2+、Cl-、CO
B.H+、Na+、Fe2+、MnO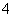
C.K+、Ca2+、Cl-、NO
D.K+、NH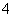 、OH-、SO
、OH-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ). 某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。(已知Al(OH)3可被NaOH溶液溶解)由此可知原溶液中:
(1)至少存在 种离子
(2)Cl- 是 存在(填“一定”“一定不”“可能”),c(Cl‑)范围是 mol/L(若存在Cl- 则计算并填写,若不存在或可能存在Cl-,则此空不填)
(3)写出产生红褐色沉淀的离子方程式:
(Ⅱ).实验室要用98%(ρ=1.84 g·cm-3)的硫酸配制3.68 mol·L-1的硫酸溶液500mL
(1)计算所需98%的硫酸 mL。
(2)要配制3.68mol·L-1的硫酸溶液500mL,准确量取一定体积的98%的硫酸后,还需用到的实验仪器是(填写序号): .
①量筒 ②烧杯 ③1000mL容量瓶 ④500mL 容量瓶 ⑤天平 ⑥胶头滴管 ⑦锥形瓶 ⑧玻璃棒
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度偏低的是 。
A.浓硫酸溶解后未冷却,直接转移至容量瓶后定容
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用量筒量取浓硫酸时,俯视读数 D.容量瓶使用前用含硫酸的溶液润洗了
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com