
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为NA | |
| C. | 1mol碳正离子CH5+所含的电子数为10NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
分析 A、气体摩尔体积的使用范围是气体,液体和固体不适用,标况下,庚烷是液体;
B、求出甲烷的物质的量,然后根据1mol甲烷消耗2mol氧气来分析;
C、每个碳正离子(CH3+)所含的电子数为8个,再根据N(电子)=8n(CH3+)NA计算含有的电子数;
D、丙烷中含有8个碳氢键,0.5mol丙烷中含有4mol碳氢键.
解答 解:A、气体摩尔体积的使用范围是气体,液体和固体不适用,标况下,庚烷是液体,故A错误;
B、16g甲烷的物质的量为1mol,而1mol甲烷消耗2mol氧气,即消耗2NA个氧气分子,故B错误;
C、每个碳正离子(CH3+)所含的电子数为8个,N(电子)=8n(CH3+)NA=8×1mol×NA=8NA,故C正确;
D、0.5molC3H8分子中含有4mol碳氢键,含C-H共价键为4NA,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
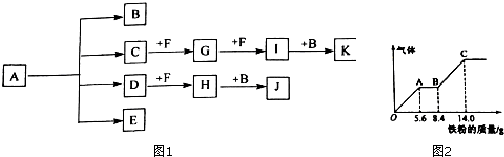
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
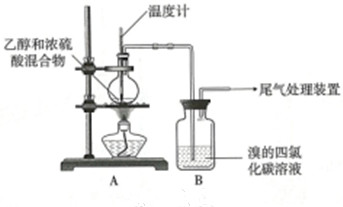
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiC | B. | SiO2 | C. | Si | D. | Si3N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1mol•L-1的NaHCO3溶液中含有阳离子的物质的量为0.2mol | |
| B. | 0.1 mol水蒸气在标准状况下体积为2.24 L | |
| C. | 在25℃,1.01×105Pa时,11.2 L氧气所含的氧原子数目为6.02×1023 | |
| D. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,含等质量氧元素的NO和CO的体积相等 | |
| B. | NO是一种有刺激性气味的红棕色气体 | |
| C. | NO易溶于水,所以可用排空气法收集 | |
| D. | NO不能通过化合反应获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法分离水和油的混合物 | |
| B. | 用过滤的方法除去NaCl溶液中含有的少量泥沙 | |
| C. | 用分液的方法分离酒精和水的混合物 | |
| D. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3易溶于水 | B. | Na2CO3比NaHCO3稳定 | ||
| C. | Na2CO3和NaHCO3都能与盐酸反应 | D. | Na2CO3俗名:小苏打 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
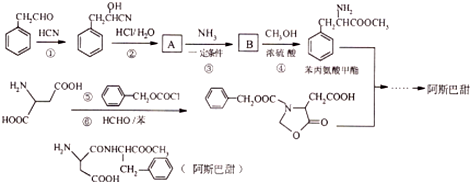
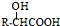 $→_{一定条件}^{NH_{3}}$
$→_{一定条件}^{NH_{3}}$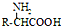
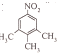 、
、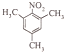 ;
;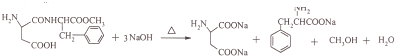 ;
;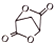 的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH:
的合成路线流程(无机试剂任选).合成路线流程示例如下 CH2═CH3$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$ CH3CH2OH: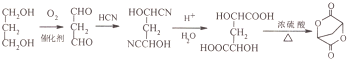 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com