
| A. | MgCl2 的物质的量浓度为0.5mol•L-1 | |
| B. | Cl-的个数为3.01×1023 | |
| C. | Mg2+的物质的量为2mol | |
| D. | Cl-的物质的量浓度为2mol•L-1 |
分析 A.根据n=$\frac{m}{M}$计算氯化镁物质的量,再根据c=$\frac{n}{V}$计算溶液浓度;
B.氯离子物质的量为氯化镁的2倍,根据N=nNA计算氯离子数目;
C.镁离子物质的量等于氯化镁的物质的量;
D.氯离子浓度为氯化镁为2倍.
解答 解:A.95g 氯化镁物质的量为$\frac{95g}{95g/mol}$=1mol,溶液物质的量浓度为$\frac{1mol}{2L}$=0.5mol/L,故A正确;
B.氯离子物质的量为氯化镁的2倍,氯离子数目为1mol×2×3.01×1023mol-1=1.204×1024,故B错误;
C.b(Mg2+)=n(MgCl2)=1mol,故C错误;
D.氯离子物质的量浓度为0.5mol/L×2=1mol/L,故D错误,
故选:A.
点评 本题考查物质的量有关计算,比较基础,注意根据电离方程式理解电解质离子与电解质浓度关系.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
| A. | 25℃,等物质的量浓度的CH3COO-、ClO-、CO32-和SO32-,结合质子能力最强的是ClO- | |
| B. | 少量的SO2通入Na2CO3溶液中反应的离子方程式为:SO2+H2O+2CO32-═2HCO3-+SO32- | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO | |
| D. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-═CO32-+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
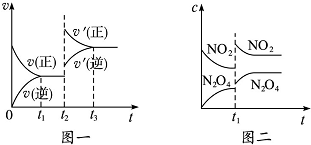 已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )
已知图一表示的是可逆反应C(s)+H2O(g)?CO(g)+H2(g)△H<0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应N2O4(g)?2NO2(g)△H>0的浓度(c)随时间(t)的变化情况.下列说法中正确的是( )| A. | 图一t2时改变的条件可能是升高了温度或增大了压强 | |
| B. | 图一t2时改变的条件是增大压强,则反应的△H增大 | |
| C. | 图二t1时改变的条件可能是升高了温度 | |
| D. | 若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、AlO2-、Cl-、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
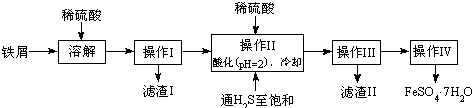
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
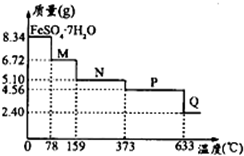
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 阳极 | 阴极 | 溶液甲 | 物质乙 | |
| A | Pt | Pt | CuCl2 | CuCl2固体 |
| B | Pt | Pt | H2SO4 | H2O |
| C | Pt | Pt | NaCl | 盐酸 |
| D | Pt | Pt | CuSO4 | CuO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
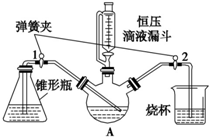 某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
某化学兴趣小组用下图实验装置进行醋酸亚铬的制备研究.已知:醋酸亚铬(其中铬元素为二价)是红棕色晶体,不溶于水,在潮湿时,Cr2+极易被氧化成 Cr3+.(备注:Cr2+在溶液中为蓝色).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去混在NO2中的NO:将气体与足量O2混合 | |
| B. | 除去混在CO2中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:加入金属钠后蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com