
硒被誉为“生命的奇效元素”,富硒食品倍受追捧,重庆多地打造富硒农产品基地。已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述错误的是( )
A.原子序数是24
B.元素周期表中硒位于第四周期第VIA族
C.最高价氧化物是SeO3,是酸性氧化物
D.气态氢化物化学式是H2Se,稳定性比HCl差
科目:高中化学 来源:2013-2014陕西省富平县高二下学期期末考试化学试卷(解析版) 题型:填空题
为测定某有机化合物A的结构,进行如下实验:
(一)分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质中各元素的原子个数比是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为________,该物质的分子式是________。
(3)根据价键理论,预测A的可能结构并写出结构简式______________________。
(二)结构式的确定:
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl—CH2—O—CH3)有两种氢原子如图2。经测定,有机物A的核磁共振氢谱示意图如图3,则A的结构简式为________。
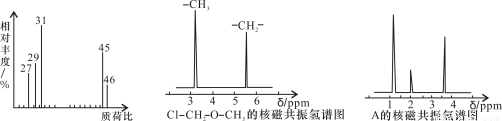
图1图2图3
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关原电池的说法中,正确的是( )
A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极
B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极
C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀
D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )
A.CO2为直线形分子,故CS2也为直线形分子
B.浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体
C.Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2
D.卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3分子中所有原子最外层都满足8e—结构
D.PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:实验题
(17分)美日科学家因研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖。有机合成常用的钯/活性炭催化剂长期使用,催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,故需对其回收再利用。一种由废催化剂制取氯化钯(PdCl2)的工艺流程如下:
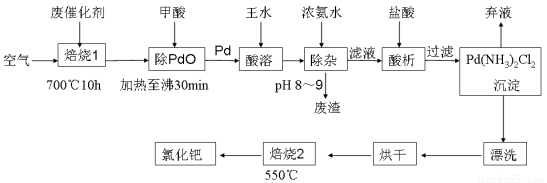
(1)甲酸还原氧化钯的化学方程式为 。
(2)加浓氨水时,钯元素转变为可溶性[Pd(NH3)4]2+,此时铁元素的存在形式是 (写化学式)。
(3)王水是浓硝酸与浓盐酸按体积比1∶3混合而成的,钯在王水中溶解的过程中有化合物A和一种无色、有毒气体B生成。
①气体B的化学式为
②经测定,化合物A由3种元素组成,有关元素的质量分数为Pd:42.4%,H:0.8%。则A的化学式为 ;
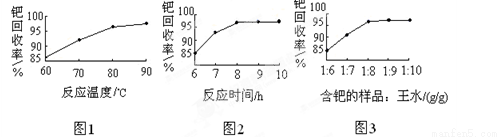
(4)钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯的适宜条件是:反应温度为 ,反应时间约为 ,含钯的样品与王水的质量比为 。
(5)700℃“焙烧1”的目的是 , 550℃“焙烧2”的目的是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市5月高三月考理综化学试卷(解析版) 题型:选择题
下列实验操作与预期的实验目的或结论均正确的是
选项 | 实验操作 | 预期的实验目的或结论 |
A | 对某白色固体进行焰色反应实验,火焰呈黄色 | 该物质为钠盐 |
B | SO2通入某红色溶液中,溶液褪色 | 该溶液为品红溶液 |
C | 蔗糖溶液中加入少量稀硫酸加热,然后加银氨溶液再加热 | 验证蔗糖在强酸性条件下是否发生水解 |
D | pH均为1的盐酸、醋酸溶液分别用蒸馏水稀释m倍、n倍后的pH相同 | m<n |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:实验题
(12分)为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如下:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中的溶液变黄时,停止加热,夹紧弹簧夹K2.
Ⅳ.打开活塞b,使约2ml的溶液流入D试管中,检验其中的离子.
V.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
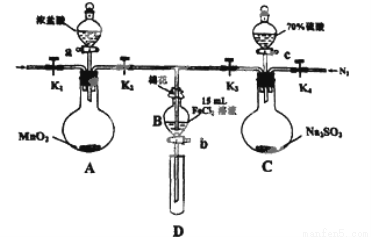
(1)过程Ⅰ的目的是______________________。
(2)棉花中浸润的溶液为__________________。
(3)A中发生反应的化学方程式为__________________________________。
(4)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是______________
(5)过程Ⅵ中检验B溶液中是否含有硫酸根的操作是________________________________
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是
| 过程IV B溶液中含有的离子 | 过程VI B溶液中含有的离子 |
甲 | 有Fe3+无Fe2+ | 有SO42﹣ |
乙 | 既有Fe3+又有Fe2+ | 有SO42﹣ |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期高三第二次诊断测试理科综合化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.在反应中消耗1mol Cl2,转移的电子数一定为2NA。
B.标准状况下,0.5mol氦气含有的电子数为NA
C.15g CH3+(碳正离子)中含有电子数为10NA
D.0.1L 2mol·L﹣1的(NH4)2S溶液中含有的S2﹣数目为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com