
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氮气在标准状况下的体积约为11.2L
B.25℃,1.01×105Pa,64gSO2中含有的原子数小于3NA
C.在常温常压下,11.2L Cl2含有的分子数为0.5NA
D.标准状况下,11.2LH2O含有的分子数为0.5NA
科目:高中化学 来源: 题型:
对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
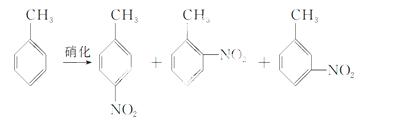
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶剂中,加入乙酸酐(有脱水作用),45 ℃反应1 h。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经 分离提纯得到对硝基甲苯。
分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是_________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或“下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_________。
(3)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
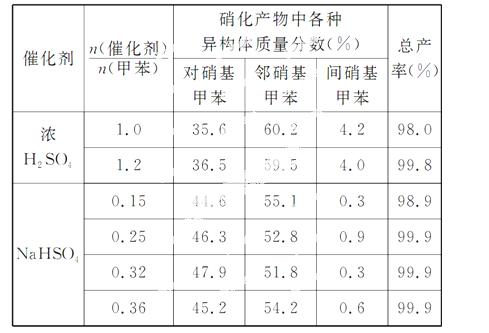
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是__________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H=-92.6 kJ.mol-1
2XY3(g) △H=-92.6 kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间 | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | |||
| ① | 1 | 3 | 0 | 2分钟 | 放热46.3kJ |
| ② | 0.4 | 1.2 | 1.2 | / | Q(Q>0) |
下列叙述不正确的是
A. 容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)=1/30 moI.L-l·s-1
B. 平衡时,两个容器中XY3的物质的量浓度相等
C. 器②中反应达到平衡时吸收的热量为Q
D. 容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 molFe2-被足量的H2O2溶液氧化,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
A、3个 B、4个 C、5个 D、全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有碳氢键的数目为NA
C.50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数
目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数小于36的X、Y、Z、W、J五种元素,原子序数依次增大,其中X元素原子半径是所有元素原子中最小的,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,J元素原子序数为24。请回答下列问题。
(1)Y、Z、W的第一电离能由小到大的顺序为________。
(2)J原子的核外电子排布式为___________________________ _____________________________________________。
(3)Y2X2分子中Y原子轨道的杂化类型为________。1 mol Y2X2分子中含有σ键与π键的数目之比为____________________________ ____________________________________________。
(4)Z与W形成的一种Z2W分子,与该分子互为等电子体的阴离子为________(任写一种)。
(5)JCl3能与Z、W的氢化物形成配位数为6的络合物,且相应两种配体的物质的量之比为2:1,氯离子全部位于外界。则该配合物的化学式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子数相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。
试回答下列有关的问题:
(1)写出F元素的电子排布式________。
(2)已知A元素的一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为________。
(3)已知C、E两种元素合成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是________。
(4)B、C、D、E的第一电离能由大到小的顺序是________(写元素符号)。四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______________(写化学式)。
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都具有球型对称结构,它们都可以看作刚性圆球,并彼此“相切”。如图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
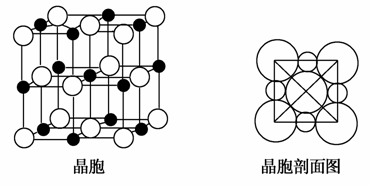
晶胞中距离一个B+最近的B+有________个。
若晶体密度为ρg·cm-3,阿伏加德罗常的值用NA表示,则E-的离子半径为________cm(用含NA与ρ的式子表达)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中Cl-浓度与50 mL 1 mol·L-1 AlCl3溶液中Cl-浓度相等的是 ( )
A .150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
.150 mL 1 mol·L-1的NaCl溶液 B.75 mL 2 mol·L-1 NH4Cl溶液
C.150 mL 2 mol·L-1的KCl溶液 D.75 mL 1 mol·L-1的FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com