
A、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于
| ||||
| B、两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 | ||||
| C、AgI比AgCl更难溶于水,所以AgCl可以转化为AgI | ||||
| D、AgCl不溶于水,不能转化为AgI |
| Ksp(AgCl) |
| 1.8×10-10 |
| Ksp(AgCl) |
| c(Ag+) |
| 1.6×10-16 | ||
|
| 1 | ||
|


科目:高中化学 来源: 题型:
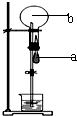 a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )
a表示胶头滴管中的液体,b表示烧瓶中的气体.不能形成喷泉实验现象的a中液体和b中气体的组合是( )| A、a-NaOH溶液、b-HCl气体 |
| B、a-NaOH溶液、b-CO2气体 |
| C、a-HCl溶液、b-NH3气体 |
| D、a-水、b-CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层呈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓度均为0.02 mol?L-1的AgNO3和CH3COONa溶液混合一定产生CH3COOAg沉淀 |
| B、将0.1 mol/LAgNO3溶液逐滴加入到0.001mol/LKCl和0.001mol/LK2S溶液中,先产生AgCl沉淀 |
| C、要使Mg2+浓度为0.12 mol?L-1的溶液中产生Mg(OH)2的沉淀,溶液的pH≥9 |
| D、向0.1mol/L AgNO3溶液中滴加0.1mol/LNaCl溶液至不再有白色沉淀生成,再向其中滴加0.1mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.则其离子方程式为:2Ag++S2-(aq)?Ag2S(s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PbCrO4先沉淀 |
| B、PbSO4先沉淀 |
| C、PbCrO4和PbSO4一起沉淀 |
| D、PbCrO4和PbSO4都不沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgI比AgCl稳定 |
| B、碘氧化性比氯弱 |
| C、I-的还原性比Cl-强 |
| D、溶度积Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下在水中溶解能力AgCl>AgBr>AgI |
| B、在AgCl饱和溶液中加入足量浓NaBr溶液有AgBr沉淀生成 |
| C、在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成 |
| D、在AgI饱和溶液中加入NaI固体有AgI沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com