
ΓΨΧβΡΩΓΩΘ®1Θ©Κœ≥…Α±ΙΛ“Β…ζ≤ζ÷–Υυ”ΟΒΡΠΝFe¥ΏΜ·ΦΝΒΡ÷ς“Σ≥…Ζ÷ «FeOΓΔFe2O3ΓΘ
ΔΌΡ≥FeOΓΔFe2O3ΜλΚœΈο÷–Θ§Χζ‘≠Ή”ΓΔ―θ‘≠Ή”ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ4ΓΟ5Θ§Τδ÷–FeOΓΔFe2O3ΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ____ΓΘ
ΔΎΒ±¥ΏΜ·ΦΝ÷–+2ΦέFe”κ+3ΦέFeΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ1ΓΟ2 ±Θ§Τδ¥ΏΜ·Μν–‘ΉνΗΏΘ§¥Υ ±ΧζΒΡ―θΜ·ΈοΒΡΜλΚœΈο÷–Χζ‘≠Ή”ΒΡ÷ ΝΩΖ÷ ΐΈΣ____ (”Ο–Γ ΐ±μ ΨΘ§±ΘΝτ2ΈΜ–Γ ΐ)ΓΘ
Θ®2Θ©ΒγΉ”ΙΛ“Β≥Θ”Ο30%ΒΡFeCl3»ή“ΚΗ· ¥Ψχ‘ΒΑε…œΒΡΆ≠≤≠Θ§÷Τ‘λ”ΓΥΔΒγ¬ΖΑεΓΘ
ΔΌ”ΟFeOœΓ―ΈΥαΓΔ¬»Τχ÷Τ»ΓFeCl3»ή“ΚΒΡάκΉ”ΖΫ≥Χ ΫΈΣ____ΓΔ____ΓΘΦλ―ι»ή“Κ÷–Fe3+ΒΡ ‘ΦΝ «____ΓΘ
ΔΎ–¥≥ωFeCl3»ή“Κ”κΫπ τΆ≠ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΘΚ____Θ§Β±ΉΣ“ΤΒγΉ” ΐΈΣ6.02ΓΝ1024 ±Θ§±Μ―θΜ·ΒΡΈο÷ ΒΡ÷ ΝΩΈΣ____ΓΘ
ΓΨ¥πΑΗΓΩ2ΓΟ1 0.72 FeO+2H+=Fe2++H2O 2Fe2++Cl2=2Fe3++2Cl- KSCN»ή“Κ 2FeCl3+Cu=2FeCl2+CuCl2 320g
ΓΨΫβΈωΓΩ
Θ®1Θ©ΔΌ…ηFeOΓΔFe2O3Έο÷ ΒΡΝΩΖ÷±πΈΣxΓΔyΘ§“άΨίΧζΓΔ―θΒΡΈο÷ ΒΡΝΩ÷°±»ΈΣ4ΘΚ5ΒΟΘΚ(x+2y)ΘΚ(x+3y)=4ΘΚ5ΘΜΫβΒΟxΘΚy=2ΘΚ1ΘΜΙ ¥πΑΗΈΣΘΚ2ΘΚ1ΘΜ
ΔΎ…η¥ΏΜ·ΦΝ÷–Κ§1molFeOΓΔ1molFe2O3Θ§‘ρ¥ΏΜ·ΦΝ÷–Χζ‘≠Ή”Έο÷ ΒΡΝΩΈΣ1mol+2mol=3molΘ§―θ‘≠Ή”Έο÷ ΒΡΝΩΈΣ1mol+3mol=4molΘ§Ι ¥ΏΜ·ΦΝ÷–Fe‘ΣΥΊ÷ ΝΩΖ÷ ΐΈΣ(3molΓΝ56g/mol)/(3molΓΝ56g/mol+4molΓΝ16g/mol)ΓΝ100%=72%=0.72ΘΜΙ ¥πΑΗΈΣΘΚ0.72ΘΜ
Θ®2Θ©ΔΌ―θΜ·―«Χζ”κ―ΈΥαΖ¥”Π…ζ≥…¬»Μ·―«ΧζΚΆΥ°Θ§―θΜ·Χζ”κ―ΈΥαΖ¥”Π…ζ≥…¬»Μ·ΧζΚΆΥ°Θ§¬»Μ·―«Χζ”ꬻΤχΖ¥”Π…ζ≥…¬»Μ·ΧζΘ§Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΖ÷±πΈΣΘΚFeO+2H+=Fe2++H2OΓΔFe2O3+6H+=2Fe3++3H2OΓΔ2Fe2++Cl2=2Fe3++2Cl-ΘΜ»ΐΦέΧζάκΉ””ωΒΫΝρ«ηΗυάκΉ”…ζ≥…―ΣΚλ…Ϊ≈δΚœΈοΘ§Ω…“‘”ΟKSCN»ή“ΚΦλ―ι»ΐΦέΧζάκΉ”ΒΡ¥φ‘ΎΘΜΙ ¥πΑΗΈΣΘΚFeO+2H+=Fe2++H2OΘΜ2Fe2++Cl2=2Fe3++2Cl-ΘΜKSCN»ή“ΚΘΜ
ΔΎ¬»Μ·Χζ”κΆ≠Ζ¥”Π…ζ≥…¬»Μ·―«ΧζΚΆ¬»Μ·Ά≠Θ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚ2FeCl3+Cu=2FeCl2+CuCl2ΘΜΗυΨίΜ·―ßΖΫ≥Χ ΫΩ…÷ΣΘ§ΉΣ“Τ2molΒγΉ”±Μ―θΜ·ΒΡΆ≠ΒΡ÷ ΝΩΈΣ64gΘ§‘ρΉΣ“ΤΒγΉ” ΐΈΣ6.02ΓΝ1024 ±Θ§Φ¥Έο÷ ΒΡΝΩΈΣ10mol ±Θ§±Μ―θΜ·ΒΡΆ≠ΒΡ÷ ΝΩΈΣ64g/molΓΝ![]() mol=320gΘΜΙ ¥πΑΗΈΣΘΚ320gΓΘ
mol=320gΘΜΙ ¥πΑΗΈΣΘΚ320gΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩάϊ”ΟCH4Ω…œϊ≥ΐNO2ΒΡΈέ»ΨΘ§Ζ¥”Π‘≠άμΈΣΘΚCH4(g)+2NO2(g)![]() N2(g) + CO2(g) +2H2O(g)Θ§‘Ύ10LΟή±’»ίΤς÷–Ζ÷±πΦ”»κ0.50mol CH4ΚΆ1.2molNO2Θ§≤βΒΟ≤ΜΆ§Έ¬Ε»œ¬n(CH4)Υφ ±Φδ±δΜ·ΒΡ”–ΙΊ Β―ι ΐΨί»γ±μΥυ ΨΘΚ
N2(g) + CO2(g) +2H2O(g)Θ§‘Ύ10LΟή±’»ίΤς÷–Ζ÷±πΦ”»κ0.50mol CH4ΚΆ1.2molNO2Θ§≤βΒΟ≤ΜΆ§Έ¬Ε»œ¬n(CH4)Υφ ±Φδ±δΜ·ΒΡ”–ΙΊ Β―ι ΐΨί»γ±μΥυ ΨΘΚ

œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ «
A.Ήι±πΔΌ÷–0 ~20 minΡΎΘ§NO2ΫΒΫβΥΌ¬ ΈΣ0.0125molLΘ≠1minΘ≠1
B.”… Β―ι ΐΨίΩ…÷ΣΈ¬Ε»T1ΘΦT2
C.40min ±Θ§±μΗώ÷–MΕ‘”ΠΒΡ ΐΨίΈΣ0.18
D.ΗΟΖ¥”Π÷Μ”–‘ΎΗΏΈ¬œ¬≤≈ΡήΉ‘ΖΔΫχ––
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ2019Ρξ3‘¬Θ§Έ“ΙζΩΤ―ßΦ“―–ΖΔ≥ω“Μ÷÷–¬–ΆΒΡ–ΩΒβΒΞ“ΚΝςΒγ≥ΊΘ§Τδ‘≠άμ»γΆΦΥυ ΨΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «

A. Ζ≈Βγ ±BΒγΦΪΖ¥”Π ΫΈΣΘΚI2+2e-=2I-
B. Ζ≈Βγ ±ΒγΫβ÷ ¥ΔΙό÷–άκΉ”Ήή≈®Ε»‘ω¥σ
C. MΈΣ―τάκΉ”ΫΜΜΜΡΛΘ§NΈΣ“θάκΉ”ΫΜΜΜΡΛ
D. ≥δΒγ ±Θ§AΦΪ‘ω÷Ί65g ±Θ§C«χ‘ωΦ”άκΉ” ΐΈΣ4NA
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣCΓΔDΓΔGΓΔIΈΣΕΧ÷ήΤΎ‘ΣΥΊ–Έ≥…ΒΡΒΞ÷ Θ§DΓΔGΓΔI≥ΘΈ¬œ¬ΈΣΤχΧ§Θ§«“GΈΣΜΤ¬Χ…ΪΘΜ–Έ≥…DΒΡ‘ΣΥΊ‘≠Ή”ΒΡΉνΆβ≤ψΒγΉ” ΐ «¥ΈΆβ≤ψΒΡ3±ΕΘΜBΒΡ―φ…ΪΖ¥”Π≥ Ήœ…Ϊ(ΆΗΙΐάΕ…Ϊνή≤ΘΝß)ΘΜKΈΣΚλΉΊ…ΪΖέΡ©ΓΘΤδΉΣΜ·ΙΊœΒ»γΆΦΓΘ

«κΜΊ¥πΘΚ
Θ®1Θ©ΙΛ“Β…œ÷ΤC”ΟA≤Μ”ΟHΒΡ‘≠“ρ ΓΘ
Θ®2Θ©–¥≥ωC”κKΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ Θ§ΗΟΖ¥”ΠΒΡΖ¥”ΠΈοΉήΡήΝΩ (ΧνΓΑ¥σ”ΎΓ±ΜρΓΑ–Γ”ΎΓ±)…ζ≥…ΈοΉήΡήΝΩΓΘ
Θ®3Θ©L «ΡΩ«Α”Π”ΟΉνΙψΖΚΒΡΫπ τΘ§”ΟΧΦΑτΉς―τΦΪΘ§LΉς“θΦΪΘ§Ϋ”Ά®Βγ‘¥(ΕΧ ±Φδ)ΒγΫβEΥ°»ή“ΚΒΡΜ·―ßΖΫ≥Χ Ϋ ΓΘ
Θ®4Θ©–¥≥ωEΈο÷ ΒΡΒγΉ” Ϋ ΓΘ
Θ®5Θ©J”κHΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ ΓΘ
Θ®6Θ©–¥≥ωG”κ λ ·Μ“Ζ¥”Π÷Τ»ΓΤ·ΑΉΖέΒΡΜ·―ßΖΫ≥Χ Ϋ ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“‘ΒγΫβ ≥―ΈΥ°ΈΣΜυ¥Γ÷Τ»Γ¬»ΤχΒ»≤ζΤΖΒΡΙΛ“Β≥ΤΈΣΓΑ¬»ΦνΙΛ“ΒΓ±Θ§Υϋ «ΡΩ«ΑΜ·―ßΙΛ“ΒΒΡ÷Ί“Σ÷ß÷υ÷°“ΜΓΘ
Θ®1Θ©»τΒγΫβ ≥―ΈΥ° ±œϊΚΡNaClΒΡ÷ ΝΩΈΣ234 gΘ§‘ρ‘Ύάμ¬έ…œΉνΕύΩ…ΒΟ¬»ΤχΒΡΧεΜΐΈΣ________…ΐ(±ξΉΦΉ¥Ωω)ΓΘ
Θ®2Θ©»τΫΪ2 molΒΡ¬»ΤχΆ®»κΉψΝΩ ·Μ“»ι÷–Θ§άμ¬έ…œΩ…ΒΟΒΫ¥Έ¬»ΥαΗΤ________ΩΥΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥Μ·―ß Β―ι–ΓΉιΒΡΆ§―ßΈΣΧΫΨΩΚΆ±»ΫœSO2ΚΆ¬»Υ°ΒΡΤ·ΑΉ–‘Θ§…ηΦΤΝΥ»γΆΦΒΡ Β―ιΉΑ÷ΟΓΘ
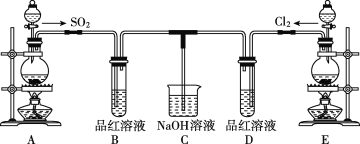
Θ®1Θ© Β―ι “”ΟΉΑ÷ΟE÷Τ±ΗCl2Θ§ΤδΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣMnO2+4HCl(≈®)![]() MnCl2+Cl2Γϋ+2H2OΓΘ»τ”–6molΒΡHCl≤ΈΦ”Ζ¥”ΠΘ§‘ρΉΣ“ΤΒΡΒγΉ”Ήή ΐΈΣ____ΓΘ
MnCl2+Cl2Γϋ+2H2OΓΘ»τ”–6molΒΡHCl≤ΈΦ”Ζ¥”ΠΘ§‘ρΉΣ“ΤΒΡΒγΉ”Ήή ΐΈΣ____ΓΘ
Θ®2Θ©ΔΌΖ¥”ΠΩΣ Φ“ΜΕΈ ±ΦδΚσΘ§Ιέ≤λΒΫBΓΔDΝΫΗω ‘Ιή÷–ΒΡΤΖΚλ»ή“Κ≥ωœ÷ΒΡœ÷œσ «ΘΚB____Θ§D____ΓΘ
ΔΎΆΘ÷ΙΆ®ΤχΚσΘ§‘ΌΗχBΓΔDΝΫΗω ‘ΙήΖ÷±πΦ”»»Θ§ΝΫΗω ‘Ιή÷–ΒΡœ÷œσΖ÷±πΈΣΘΚB____Θ§D____ΓΘ
Θ®3Θ©Νμ“ΜΗω Β―ι–ΓΉιΒΡΆ§―ß»œΈΣSO2ΚΆ¬»Υ°ΕΦ”–Τ·ΑΉ–‘Θ§Εΰ’ΏΜλΚœΚσΒΡΤ·ΑΉ–‘ΩœΕ®ΜαΗϋ«ΩΓΘΥϊΟ«ΫΪ÷ΤΒΟΒΡSO2ΚΆCl2Α¥1ΓΟ1Ά§ ±Ά®»κΒΫΤΖΚλ»ή“Κ÷–Θ§ΫαΙϊΖΔœ÷Ά …Ϊ–ßΙϊ≤Δ≤ΜœώœκœσΒΡΡ«―υΓΘ«κΡψΖ÷ΈωΗΟœ÷œσΒΡ‘≠“ρ(”ΟΜ·―ßΖΫ≥Χ Ϋ±μ Ψ)ΘΚ____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΡ≥“ΚΧ§¬±¥ζΆιRX(R «ΆιΜυΘ§X «Ρ≥÷÷¬±‘≠Ή”)ΒΡΟήΕ» «a gcm©¹3Θ°RXΩ…“‘”κœΓΦνΖΔ…ζΥ°ΫβΖ¥”Π…ζ≥…ROH(ΡήΗζΥ°ΜΞ»ή)ΚΆHXΘ°ΈΣΝΥ≤βΕ®RXΒΡœύΕ‘Ζ÷Ή”÷ ΝΩΘ§ΡβΕ®ΒΡ Β―ι≤Ϋ÷η»γœ¬ΘΚ
ΔΌΉΦ»ΖΝΩ»ΓΗΟ¬±¥ζΆιb mLΘ§Ζ≈»κΉΕ–ΈΤΩ÷–Θ°
ΔΎ‘ΎΉΕ–ΈΤΩ÷–Φ”»κΙΐΝΩœΓNaOH»ή“ΚΘ§»ϊ…œ¥χ”–≥Λ≤ΘΝßΙήΒΡ»ϊΉ”Θ§Φ”»»Θ§ΖΔ…ζΖ¥”ΠΘ°
ΔέΖ¥”ΠΆξ≥…ΚσΘ§ά以»ή“ΚΘ§Φ”œΓœθΥαΥαΜ·Θ§ΒΈΦ”ΙΐΝΩAgNO3»ή“ΚΒΟΒΫΑΉ…Ϊ≥ΝΒμΘ°
ΔήΫΪ≥ΝΒμΙΐ¬ΥΓΔœ¥Β”ΓΔΗ…‘οΚσ≥Τ÷ΊΘ§ΒΟΒΫΙΧΧεc gΘ°
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)ΉΑ÷Ο÷–≥Λ≤ΘΝßΙήΒΡΉς”Ο «____________________________Θ°
(2)ΗΟ¬±¥ζΆι÷–ΥυΚ§¬±ΥΊΒΡΟϊ≥Τ «________Θ§≈–Εœ“άΨί «________________
(3)»γRΈΣ““ΜυΘ§‘ρRX”κKOH¥Φ»ή“ΚΖ¥”ΠΒΡΖΫ≥Χ Ϋ________________
(4)»γΙϊ‘Ύ≤Ϋ÷ηΔέ÷–Θ§Φ”HNO3ΒΡΝΩ≤ΜΉψΘ§ΟΜ”–ΫΪ»ή“ΚΥαΜ·Θ§‘ρ≤Ϋ÷ηΔή≤βΒΟΒΡc÷Β________________
AΘ°ΤΪ¥σ BΘ°ΤΪ–Γ CΘ°≤Μ±δ DΘ°¥σ–Γ≤ΜΕ®Θ°
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®ΔώΘ©ΙΛ“ΒΈ≤ΤχSO2ΓΔNO2 «Έέ»Ψ¥σΤχΓΔ–Έ≥…Υα”ξΒΡΉοΩΐΜω ΉΓΘ«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ“λ«ηΥα(Μ·―ß ΫΘΚHNCOΘ§CΈΣ+4Φέ)Ω…”Ο”Ύœϊ≥ΐΈ≤Τχ÷–ΒΡNO2ΓΘΤδΖ¥”Π‘≠άμΈΣΘΚHNCO+NO2ΓζN2+CO2+![]() (Έ¥≈δΤΫ)ΓΘ
(Έ¥≈δΤΫ)ΓΘ
ΔΌ…œ ωΖ¥”ΠΒΡ―θΜ·ΦΝ «____________ΓΘ
ΔΎ≈δΤΫΚσΖΫΩρΡΎ”ΠΧν–¥____________ΓΘ
ΔέΟΩ¥Πάμ33.6LNO2(±ξΉΦΉ¥Ωω)Θ§Ζ¥”Π÷–ΉΣ“ΤΒγΉ”ΒΡ ΐΡΩΈΣ____________ΓΘ
Θ®ΔρΘ©ΈΣΝΥΦθ…ΌCOΕ‘¥σΤχΒΡΈέ»ΨΘ§Ρ≥―–ΨΩ–‘―ßœΑ–ΓΉιΡβ―–ΨΩάϊ”ΟCOΚΆH2OΖ¥”ΠΉΣΜ·ΈΣ¬Χ…ΪΡή‘¥H2Θ°“―÷ΣΘΚ2COΘ®gΘ©+O2Θ®gΘ©®T2CO2Θ®gΘ©ΓςH=©¹566.0kJ mol©¹1ΘΜ2H2Θ®gΘ©+O2Θ®gΘ©®T2H2OΘ®gΘ©ΓςH=©¹483.6kJ mol©¹1ΘΜ2H2OΘ®gΘ©®TH2OΘ®lΘ©ΓςH=©¹44.0kJ mol©¹1ΓΘ
Θ®1Θ©–¥≥ωCOΚΆH2OΘ®gΘ©Ής”Ο…ζ≥…CO2ΚΆH2ΒΡ»»Μ·―ßΖΫ≥Χ ΫΘΚ____________ΓΘ
Θ®2Θ©«βΤχ «Κœ≥…Α±ΒΡ÷Ί“Σ‘≠ΝœΘ§Κœ≥…Α±Ζ¥”ΠΒΡ»»Μ·―ßΖΫ≥Χ Ϋ»γœ¬ΘΚN2Θ®gΘ©+3H2Θ®gΘ©![]() 2NH3Θ®gΘ©ΓςH=©¹92.4kJmoL©¹1ΓΘ
2NH3Θ®gΘ©ΓςH=©¹92.4kJmoL©¹1ΓΘ
ΔΌΒ±Κœ≥…Α±Ζ¥”Π¥οΒΫΤΫΚβΚσΘ§ΗΡ±δΡ≥“ΜΆβΫγΧθΦΰΘ®≤ΜΗΡ±δN2ΓΔH2ΚΆNH3ΒΡΝΩΘ©Θ§Ζ¥”ΠΥΌ¬ ”κ ±ΦδΒΡΙΊœΒ»γΆΦΥυ ΨΘ°ΆΦ÷–t3 ±“ΐΤπΤΫΚβ“ΤΕ·ΒΡΧθΦΰΩ…Ρή «______Θ§Τδ÷–±μ ΨΤΫΚβΜλΚœΈο÷–NH3ΒΡΚ§ΝΩΉνΗΏΒΡ“ΜΕΈ ±Φδ «______ΓΘ

ΔΎΈ¬Ε»ΈΣTΓφ ±Θ§ΫΪ1mol N2ΚΆ2mol H2Ζ≈»κ»ίΜΐΈΣ0.5LΒΡΟή±’»ίΤς÷–Θ§≥δΖ÷Ζ¥”ΠΚσ≤βΒΟN2ΒΡΤΫΚβΉΣΜ·¬ ΈΣ50%Θ°‘ρΖ¥”Π‘ΎTΓφ ±ΒΡΤΫΚβ≥Θ ΐΈΣ______mol©¹2L2ΓΘ
ΔέΡΩ«ΑΙΛ“ΒΚœ≥…Α±ΒΡ‘≠άμ «ΘΚN2+3H2![]() 2NH3»γΆΦ±μ ΨΥφΧθΦΰΗΡ±δΘ§ΤΫΚβΧεœΒ÷–Α±ΤχΧεΜΐΖ÷ ΐΒΡ±δΜ·«ς ΤΘ§Β±ΚαΉχ±ξΈΣ―Ι«Ω ±Θ§±δΜ·«ς Τ’ΐ»ΖΒΡ «Θ®Χν–ρΚ≈Θ§œ¬Ά§Θ©___Θ§Β±ΚαΉχ±ξΈΣΈ¬Ε» ±Θ§±δΜ·«ς Τ’ΐ»ΖΒΡ «___ΓΘ
2NH3»γΆΦ±μ ΨΥφΧθΦΰΗΡ±δΘ§ΤΫΚβΧεœΒ÷–Α±ΤχΧεΜΐΖ÷ ΐΒΡ±δΜ·«ς ΤΘ§Β±ΚαΉχ±ξΈΣ―Ι«Ω ±Θ§±δΜ·«ς Τ’ΐ»ΖΒΡ «Θ®Χν–ρΚ≈Θ§œ¬Ά§Θ©___Θ§Β±ΚαΉχ±ξΈΣΈ¬Ε» ±Θ§±δΜ·«ς Τ’ΐ»ΖΒΡ «___ΓΘ

Θ®3Θ©≥ΘΈ¬œ¬Α±ΤχΚΆHClΨυΦΪ“Ή»ή”ΎΥ°Θ§œ÷ΫΪœύΆ§ΧεΜΐΓΔœύΆ§Έο÷ ΒΡΝΩ≈®Ε»ΒΡΑ±Υ°ΚΆ―ΈΥαΜλΚœΘ§ΥυΒΟ»ή“Κ÷–ΗςάκΉ”ΒΡΈο÷ ΒΡΝΩ≈®Ε»Α¥’’”…¥σΒΫ–ΓΒΡΥ≥–ρ≈≈Ν–“ά¥ΈΈΣ____ΘΨ____ΘΨ____ΘΨ____ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“ΜΗωΒγΜ·―ßΙΐ≥ΧΒΡ Ψ“βΆΦ»γΆΦΥυ ΨΓΘ

«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(l)Ά®»κCH3CH2OH“ΜΦΪΒΡΒγΦΪΖ¥”Π ΫΈΣ__________________________ΓΘ
(2)““≥Ί «Ά≠ΒΡΨΪΝΕ≥ΊΘ§‘ρAΒγΦΪΒΡ≤ΡΝœ «_____________ΘΜΖ¥”Π“ΜΕΈ ±ΦδΚσΘ§““≥Ί»ή“Κ÷–c(Cu2ΘΪ)__________(ΧνΓΑ‘ω¥σΓ±ΓΑ±δ–ΓΓ±ΜρΓΑ≤Μ±δΓ±)ΓΘ
(3)±ϊ≥ΊΚ§”–0.01 mol KClΒΡ»ή“Κ100mLΘ§ΦΌ»γΒγ¬Ζ÷–ΉΣ“ΤΝΥ0.03 mol eΘ≠Θ§‘ρ―τΦΪ≤ζ…ζΒΡΤχΧε‘Ύ±ξΉΦΉ¥Ωωœ¬ΒΡΧεΜΐ «________ΓΘ
(4)±ϊ≥Ί÷–ΒΈ”–Ζ”ΧΣΘ§ Β―ιΩΣ ΦΚσΙέ≤λΒΫΒΡœ÷œσ «_______________________________Θ§–¥≥ω±ϊ≥ΊΒΡΉήΖ¥”ΠΖΫ≥Χ ΫΘΚ________________________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com