
| A、在常温常压下,11.2L H2含有的分子数为0.5NA |
| B、32g O2所含原子数目为2NA |
| C、1mol HCl含有的电子数为2NA |
| D、在标准状况下,22.4L H2O含有的质子数为10NA |
| m |
| M |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
| A、硫氰化钾溶液:Na+、Cl-、SO42-、Fe3+ |
| B、使紫色石蕊试液变红的溶液:Fe2+、Mg2+、ClO-、Cl- |
| C、氢氧化钠溶液:K+、Ba2+、Cl-、Br- |
| D、碳酸钠溶液:K+、SO42-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜片加入三氯化铁溶液中:Cu+2Fe3+═2Fe2++Cu2+ |
| B、盐酸中加入碳酸钙:CO32-+2H+═H2O+CO2↑ |
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| D、NaHCO3溶液中加入盐酸:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 同学们为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.2mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
同学们为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.2mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验 编号 |
温度(K) | 盐酸浓度 (mol?L-1) |
醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | / | a.实验①和②是探究 b.实验①和③是探究 c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. |
| ② | 308 | 0.20 | / | |
| ③ | 298 | 0.40 | / | |
| ④ | 0.20 | / |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):请回答:
物质A~G均由短周期元素组成,A、B为非金属气体单质,B原子最外层电子数比次外层电子数的2倍还多1.甲、乙均为金属单质,且甲的原子半径在第三周期最大.各物质间的转化关系如下(部分生成物未给出,且未注明反应条件):请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2的水溶液可以导电,说明Cl2是电解质 |
| B、在高温条件下,C能置换出SiO2中的Si,说明C的氧化性强于Si |
| C、向淀粉碘化钾的溶液中加入氯水,溶液变为蓝色,说明Cl2的氧化性强于I2 |
| D、在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液,溶液褪色,说明BaCl2溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL |
| B、190mL |
| C、150mL或190mL |
| D、180mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
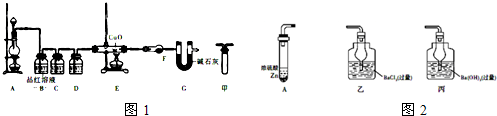
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)已知:N≡N的键能是946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,请根据此次而出合成氨反应的热化学方程式
(1)已知:N≡N的键能是946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,请根据此次而出合成氨反应的热化学方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com