
| A. | 在铁件上镀银时,金属银作电解槽的阴极 | |
| B. | 用石墨电极电解硫酸溶液,其实质是电解水,故溶液PH值不变 | |
| C. | 电解法精炼铜时,电解一段时间后,电解液中C(Cu2+)将略有下降 | |
| D. | 为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的正极相连 |
分析 A.电镀池本质是电解池,但电镀池中,镀层金属作阳极,镀件作阴极,电镀液含有镀层金属阳离子;
B.根据离子放电顺序可知,实质是电解水,硫酸物质的量不变,但溶液体积减小;
C.阳极上,粗铜中比Cu活泼的金属首先放电,然后Cu再放电形成Cu2+进入溶液,而阴极上是铜离子放电析出Cu;
D.构成电解池进行金属防护时,被保护的金属应作阴极.
解答 解:A.在铁件上镀银时,金属银作电解槽的阳极,铁件作阴极,故A错误;
B.根据离子放电顺序可知,用石墨电极电解硫酸溶液,实质是电解水,硫酸物质的量不变,但溶液体积减小,溶液酸性增强,则溶液pH减小,故B错误;
C.阳极上,粗铜中比Cu活泼的金属首先放电,然后Cu再放电形成Cu2+进入溶液,而阴极上是铜离子放电析出Cu,由电子转移守恒可知,阴极析出的Cu比阳极消耗的Cu多,则电解液中C(Cu2+)将略有下降,故C正确;
D.为防止深埋地下的钢铁管道腐蚀,可将其与直流电源的负极相连,为外加电流的阴极保护法,故D错误,
故选:C.
点评 本题考查电解工作原理及其应用,涉及电镀、粗铜精炼、金属腐蚀与防护,关键理解电解池工作原理,注意电镀池中镀层金属作阳极,镀件作阴极,电镀液含有镀层金属阳离子.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8KJ/mol | |
| B. | C2H4(g)+O2(g)═2CO2(g)+2H2O(l)△H=-1411.0KJ/mol | |
| C. | CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-6071.3KJ/mol | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8KJ/mol |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一上10月月考化学试卷(解析版) 题型:选择题
下列属于电解质并能导电的物质是
A.熔融的NaCl B.KNO3溶液 C.单质铜 D.酒精
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
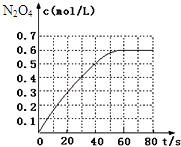 298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)?N2O4(g)△H=-a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )| A. | v(正)>v(逆) | B. | v(正)<v(逆) | ||
| C. | v(正)=v(逆) | D. | v(正)、v(逆)大小关系不确定 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
对于化学反应3W(g)+2X(g)=4Y(g)+3Z(g),下列反应速率关系中,正确的是
A.υ(W)=3υ(Z) B.2υ(X)=3υ(Z) C.2υ(X)=υ(Y) D.3υ(W)=2υ(X)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | Al3+ | C. | Fe3+ | D. | Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
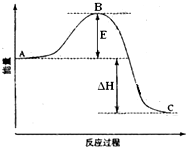 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
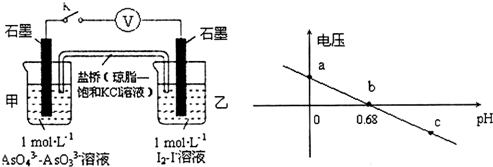
| A. | a点时,盐桥中K+向左移动 | |
| B. | b点时,反应处于化学平衡状态 | |
| C. | c点时,正极的电极反应为AsO43-+2H++2e-=AsO33-+H2O | |
| D. | pH>0.68时,氧化性I2>AsO43- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com