
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
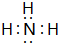 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. 分析 A元素最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为H元素;B是地壳中含量最多的元素,则B为O元素;单质C须保存在煤油中,则C为Na;D的单质与NaOH溶液反应可用于生产漂白液,则D为Cl元素;E的单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe.
解答 解:A元素最高价氧化物对应的水化物与其氢化物反应生成离子化合物,则A为H元素;B是地壳中含量最多的元素,则B为O元素;单质C须保存在煤油中,则C为Na;D的单质与NaOH溶液反应可用于生产漂白液,则D为Cl元素;E的单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏,则E为Fe.
(1)A的氢化物分子为NH3,电子式是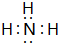 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+,
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+,
故答案为: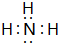 ;NH3+H+=NH4+;
;NH3+H+=NH4+;
(2)B、C组成的某种化合物和B的某种氢化物反应可生成B的单质,应是过氧化钠与水反应生成氢氧化钠与仪器,过氧化钠中含有离子键、共价键,
故答案为:离子键、共价键;
(3)A、D的氢化物相互反应,产生白色固体为NH4Cl,该固体中阳离子为NH4+,检验方法为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生),
故答案为:取该白色固体少许于试管中,加入适量浓NaOH溶液并加热,用湿润的红色石蕊试纸接近试管口检验放出的气体,若试纸变蓝(或用蘸有浓盐酸的玻璃棒靠近试管口,有白烟产生).
点评 本题考查结构性质位置关系应用,题目难度不大,根据物质的性质推断元素的种类是解题关键,注意掌握铵根离子的检验方法.


科目:高中化学 来源: 题型:选择题
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
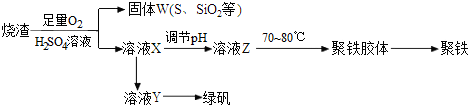

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间的曲线如图所示:下列描述不正确的是( )| A. | 反应开始到10s,用Z表示的反应速率为0.04 mol/(L•s) | |
| B. | 反应开始到10s,X的物质的量浓度增加了0.8 mol/L | |
| C. | 反应开始到10s时,Y的转化率为80.0% | |
| D. | 反应的化学方程式为:4Z(g)+5Y(g)═8X(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态单质分子中一定存在共价键 | |
| B. | 氯化钠熔化或氯化氢溶于水时都要破坏化学键 | |
| C. | 金属甲、乙各1mol均和足量的盐酸反应,甲比乙失电子多,说明甲的金属性比乙的金属性强 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com