
 C(g) �ﵽƽ��ʱ��C���������Ϊ40�����Իش��й����⣺
C(g) �ﵽƽ��ʱ��C���������Ϊ40�����Իش��й����⣺ ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3(g) ��H=" �C196.6" kJ��mol-1
2SO3(g) ��H=" �C196.6" kJ��mol-1 2NO2(g) ��H=" �C113.0" kJ��mol-1
2NO2(g) ��H=" �C113.0" kJ��mol-1 SO3(g)+NO(g)�Ħ�H= kJ��mol-1��
SO3(g)+NO(g)�Ħ�H= kJ��mol-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
 2NH3��g����ע:Ҫ��ÿ����Ҫд��������̣�
2NH3��g����ע:Ҫ��ÿ����Ҫд��������̣� ������NH3�ĺ��������������Ϊ25%������ƽ��ʱNH3�����ʵ�
������NH3�ĺ��������������Ϊ25%������ƽ��ʱNH3�����ʵ� ����
�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
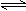 2NH3(g)����H����92.4 kJ��mol��1��
2NH3(g)����H����92.4 kJ��mol��1��| A�������¶� | B�����ʺϴ������Ե��ʵ����� | C������ѹǿ | D������ѹǿ |
 ����
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)����H
2NH3(g)����H ��0�������о�Ŀ�ĺ�ʾ��ͼ�������
��0�������о�Ŀ�ĺ�ʾ��ͼ�������| | A | B | C | D |
| �о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
| ͼʾ | 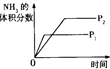 | 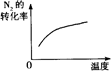 | 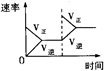 |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3
2SO3 �д�ʩ���е��ǣ� ��
�д�ʩ���е��ǣ� ��A���������������ʵ��� | B����С���������ʵ��� |
| C�����������������ʵ��� | D�������¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC��g�����ﵽƽ��ʱ��ά���¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ�µ�ƽ��ʱ������C��Ũ�ȱ�Ϊԭƽ��ʱ��1.9����������˵����ȷ���ǣ� ��
pC��g�����ﵽƽ��ʱ��ά���¶Ȳ��䣬�����������С��ԭ����1/2�����ﵽ�µ�ƽ��ʱ������C��Ũ�ȱ�Ϊԭƽ��ʱ��1.9����������˵����ȷ���ǣ� ��| A��m+n��p | B��m+n��p |
| C��ƽ��������Ӧ�����ƶ� | D��C�������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Z(g)(δ��ƽ)���¶�ΪT0ʱ�����ݻ��̶��������з�����Ӧ�����ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1��T2ʱ������Ӧ��Z��Ũ����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ���ǣ� ��
Z(g)(δ��ƽ)���¶�ΪT0ʱ�����ݻ��̶��������з�����Ӧ�����ʵ�Ũ����ʱ��仯�Ĺ�ϵ��ͼa��ʾ������������ͬ���¶ȷֱ�ΪT1��T2ʱ������Ӧ��Z��Ũ����ʱ��仯�Ĺ�ϵ��ͼb��ʾ������������ȷ���ǣ� ��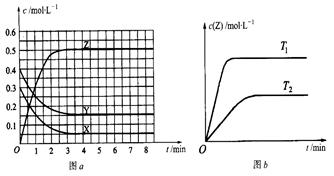
| A��������Ӧʱ�������ʵķ�Ӧ���ʴ�С��ϵΪ��v(X)=" v(Y)=" 2v(Z) |
| B��ͼa�з�Ӧ�ﵽƽ��ʱ��Y��ת����Ϊ37.5% |
| C��T0��ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ33.3 |
| D���÷�Ӧ����Ӧ�ķ�Ӧ�ȡ�H<0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO��g����H2O��g����
CO��g����H2O��g����| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com