
 硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:
硼、碳、硅元素的单质及其化合物的构成自然界的重要物质.请回答下列问题:| CaO或MgO |
| △ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、乙烯通入溴水使之褪色 |
| B、乙烯使酸性高锰酸钾溶液褪色 |
| C、四氯化碳与溴水混合振荡,静置后溴水褪色 |
| D、在催化剂作用下生成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
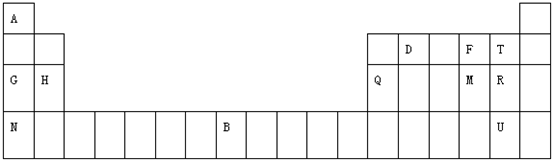

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| B、25℃与60℃时,0.005mol/L的硫酸溶液pH相等 |
| C、中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n(NaOH)相等 |
| D、常温下,将pH=5的醋酸溶液稀释到原体积的1000倍后,溶液的pH≈7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com