
Ⅰ.过氧化氢(H2O2)的水溶液俗称双氧水,近年来倍受人们的青睐,被称为“绿色氧化剂”。
⑴写出H2O2的电子式_________________,其分子内存在______键和_______键。
⑵你认为H2O2被成为“绿色氧化剂”的主要原因是________________________________________。
⑶与H2O2分子具有相同电子数的双原子单质分子为(写化学式)______________,与H2O2分子具有相同电子数的三原子化合物分子为(写化学式)______________。
⑷某工业废水中含有一定量氯气,为了除去氯气,常加入H2O2作脱氯剂,写出该反应的化学方程式为___________________________________________,反应中H2O2作_____________剂。
⑸将双氧水加入用盐酸酸化的FeCl2溶液中,溶液由浅绿色变为棕黄色,写出该反应的离子方程式为___________________________________________,反应中H2O2作_____________剂。
⑹双氧水能使酸性高锰酸钾溶液褪色,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里:
MnO4-+ H2O2+ H+ === Mn2++ H2O+ 。
Ⅱ.某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2,已知该反应中H2O2只发生如下过程:H2O2→ O2
⑴该反应的化学方程式为_____________________________________________。
⑵如反应转移了0.3mol电子,则产生的气体在标准状况下体积为
Ⅰ.⑴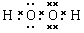 ,极性键
非极性键 ⑵H2O2的还原产物为水,对环境无污染
,极性键
非极性键 ⑵H2O2的还原产物为水,对环境无污染
⑶F2 H2S ⑷Cl2+H2O2=2HCl+O2↑ 还原剂
⑸2Fe2++H2O2+2H+=2Fe3++2H2O 氧化剂 ⑹ 2 5 6 = 2 8 5O2↑
Ⅱ.⑴3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O ⑵3.36L
【解析】Ⅰ.、(1)过氧化氢是含有极性键和非极性键的共价化合物,电子式是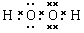 。
。
(2)由于H2O2的还原产物为水,对环境无污染,所以过氧化氢被称为绿色氧化剂。
(3)双氧水中含有18个电子,所以与H2O2分子具有相同电子数的双原子单质分子为F2,而与H2O2分子具有相同电子数的三原子化合物分子为H2S。
(4)氯气具有强氧化性,能把双氧水氧化生成氧气和水,反应的方程式是Cl2+H2O2=2HCl+O2↑。
(5)双氧水具有氧化性,能把亚铁离子氧化生成铁离子,反应的方程式是2Fe2++H2O2+2H+=2Fe3++2H2O。
(6)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的化学计量数依次是2 5 6 = 2 8 5O2↑。
Ⅱ.、(1)双氧水生成氧气的过程是被氧化的过程,即双氧水作还原剂,所以铬酸是氧化剂,因此反应的方程式是3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O。
(2)根据方程式可知,反应中转移6个电子,所以如反应转移了0.3mol电子,则产生的气体是0.15mol,标准状况下的体积是0.15mol×22.4L/mol=3.36L。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 简单实验方案 | 预测的实验现象 | 结论 |
向褪色后的溶液中再加入过量NaOH溶液 向褪色后的溶液中再加入过量NaOH溶液 |
溶液又变红色 溶液又变红色 |
假设 ① ① 成立 |
溶液颜色无变化 溶液颜色无变化 |
假设 ② ② 成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化氢与过氧化钠中含有化学键的类型完全相同 | B、H216O、D216O、H218O、D218O互为同素异形体 | C、因为NH4HCO3是强电解质,所以在其水溶液中只存在水解平衡,不存在电离平衡 | D、北京奥运会奖牌--“金镶玉”奖牌玉的化学成分多为含水钙镁硅酸盐,如:Ca2Mg5Si8O22(OH)2可用氧化物表示为:2CaO?5MgO?8SiO2?H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com