
| A. | 碘水、淀粉溶液 | B. | 溴水、汽油 | ||
| C. | 氯水、四氯化碳 | D. | 硝酸银溶液、稀硝酸 |
分析 鉴别NaCl、NaBr、NaI,可根据阴离子的性质不同以及氧化性强弱Cl2>Br2>I2判断反应的可能性,并结合萃取现象及卤化银沉淀的颜色进行检验.
解答 解:A.均不与碘水反应,现象相同,不能鉴别,故A错误;
B.只有NaI与溴水反应,不能鉴别NaCl、NaBr,故B错误;
C.氯水与NaBr、NaI反应分别生成溴、碘,则再加四氯化碳,出现不同现象,分别为分层后下层橙红色、分层后下层为褐色,现象不同,可鉴别,故C正确;
D.分别生成AgCl、AgBr、AgI沉淀,现象分别为白色、浅黄色、黄色,可鉴别,故D正确.
故选CD.
点评 本题考查物质的鉴别,为高频考点,侧重物质性质及性质差异的考查,把握氧化性的强弱及反应中的不同现象为解答的关键,侧重氧化还原及萃取现象的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ; B的结构简式CH3CH2CHO;B的物质的量0.06mol;
; B的结构简式CH3CH2CHO;B的物质的量0.06mol;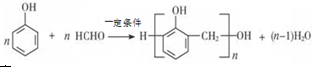 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
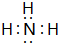 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用离子方程式表示)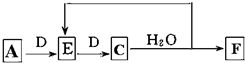
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
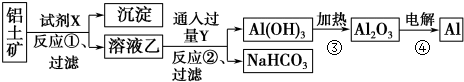
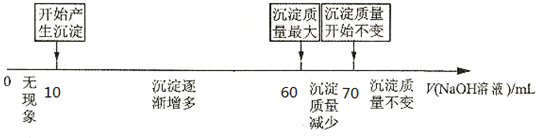
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| B. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H1②2H2(g)+O2(g)=2H2O(1)△H2,则△H1<△2 | |
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJ•mol-1,②C(s,金刚石)+O2(g)═CO2(g)△H=-395.0 kJ•mol-1 则C(s,石墨)=C(s,金刚石)△H=-1.5 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 将1mol•L-1 NaAlO2溶液和1.5mol•L-1的HCl溶液等体积互相均匀混合:6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+ | |
| C. | 向Al2(SO4)3溶液中加入过量NH3•H2O:Al3++4NH3•H2O=[Al(OH)4]-+4NH4+ | |
| D. | 铵明矾[NH4Al(SO4)2•12H2O]溶液中加入过量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙溶液中溶质的质量分数均大于5% | |
| B. | 甲溶液中溶质的质量分数小于5%,乙、丙溶液中溶质的质量分数大于5% | |
| C. | 甲溶液中溶质的质量分数小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶质的质量分数均等于5% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石与石墨互为同素异形体 | |
| B. | 11.5 g金属钠的物质的量为0.5 mol | |
| C. | 44 g CO2在标准状况下的体积为22.4 L | |
| D. | 该反应中碳元素发生了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com