
【题目】下列各电离方程式中,书写正确的是( )
A.CH3COOH![]() H++CH3COO-
H++CH3COO-
B.KHSO4![]() K++H++ SO42-
K++H++ SO42-
C.Al(OH)3![]() Al3++3OH-
Al3++3OH-
D.H2CO3![]() 2H++ CO32-
2H++ CO32-
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】工业上用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。反应的平衡常数如下表:
CH3OH(g)。反应的平衡常数如下表:

下列说法正确的是( )
A.该反应的△H>0
B.加压、增大H2浓度和加入催化剂都能提高CO的转化率
C.工业上采用高温高压的条件,目的都是提高原料气的转化率
D.t℃时,向1L密闭容器中投入0.1molCO和0.2molH2,平衡时CO转化率为50%,则该温度时反应的平衡常数的数值为100
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)KHSO4溶液的pH______(填“>”“<”或“=”)7,用离子方程式表示为___________。
(2)KHCO3溶液的pH_____(填“>”“<”或“=”)7,用离子方程式表示为____________。
(3)将上述两种溶液混合,现象是_______________,用离子方程式表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组表述中,两种微粒不属于同种元素原子的是![]()
A.M层全充满而N层为![]() 的原子和位于第四周期第IB族的原子
的原子和位于第四周期第IB族的原子
B.2p能级有一个空轨道的基态原子和最外层电子数是次外层电子数二倍的原子
C.价电子排布为![]() 的原子和原子序数为20的原子
的原子和原子序数为20的原子
D.3p能级有两个空轨道的基态原子和M层电子数为1的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多金属及他们的化合物在科学研究和工业生产中具有许多用途,回答下列有关问题
![]() 下列有关的说法正确的是 ______
下列有关的说法正确的是 ______
A、第一电离能大小:![]()
B、因为晶格能CaO比KCl高,所以KCl比CaO熔点低
C、![]() 与
与![]() 的化学性质类似,分子结构也都呈直线型,相同条件下
的化学性质类似,分子结构也都呈直线型,相同条件下![]() 的溶解度更大
的溶解度更大
D、分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
![]() 镍
镍![]() 可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图所示,分子内含有的作用力有 ______
可形成多种配合物,且各种配合物有广泛的用途。某镍配合物结构如图所示,分子内含有的作用力有 ______ ![]() 填序号
填序号![]()
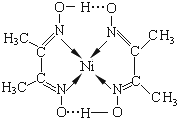
A.氢键 ![]() 离子键
离子键 ![]() 共价键 D.金属键
共价键 D.金属键 ![]() 配位键
配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 ______ ![]() 甲基
甲基![]() 中C原子的杂化方式为 ______
中C原子的杂化方式为 ______
![]() 铁和铜在生产和生活中有重要应用,基态
铁和铜在生产和生活中有重要应用,基态![]() 的M层电子排布式为 ______ ,用晶体的x射线衍射发可以测得阿伏伽德罗常数,对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为
的M层电子排布式为 ______ ,用晶体的x射线衍射发可以测得阿伏伽德罗常数,对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为![]() 提示:
提示:![]() ,
,![]() ,又知铜的密度为
,又知铜的密度为![]() ,则铜晶胞的质量是 ______
,则铜晶胞的质量是 ______ ![]() 保留两位小数
保留两位小数![]() ;阿伏加德罗常数为 ______
;阿伏加德罗常数为 ______ ![]() 保留两位小数
保留两位小数![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以软锰矿(主要成分为MnO2、SiO2、Al2O3)和黄铁矿(FeS2、SiO2)为原料冶炼金属锰的工艺流程如图所示:
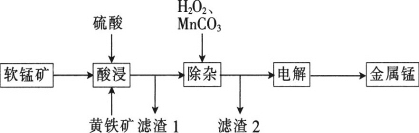
已知相关金属离子[c(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH如下:
金属离子 | Fe3+ | Mn2+ | Al3+ |
开始沉淀的pH | 2.7 | 8.3 | 3.2 |
沉淀完全的pH | 3.7 | 9.8 | 5.0 |
回答下列问题:
(1)MnO2本身不能溶于硫酸,但是在Fe2+的作用下却能溶解,写出该反应的离子方程式:____________________________。
(2)滤渣1的成分除了SiO2外,还有一种淡黄色的物质是_______________(填化学式)。
(3)除杂步骤中加入的MnCO3的作用是____________________________,该过程需调节溶液pH的范围是___________________________,若把pH调得过高,其后果是_________________________。
(4)用惰性电极进行电解,电解刚开始时阴极的电极反应式为____________________,电解后阳极的电解质溶液可返回_______________________(填“酸浸”“除杂”或“电解”)工序继续使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡及其对应的平衡常数:
CH3COOH![]() CH3COO-+H+ K1=1.75×10-5
CH3COO-+H+ K1=1.75×10-5
CH3COO-+H2O![]() CH3COOH+OH- K2=5.71×10-10
CH3COOH+OH- K2=5.71×10-10
常温下,将等体积、等物质的量浓度的醋酸和醋酸钠溶液混合,下列叙述正确的是( )
A.对混合溶液进行加热,K1增大、K2减小
B.混合溶液的pH>7
C.混合溶液中c(CH3COO-)>c(Na+)
D.温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二醇可通过下列路线合成(某些反应的反应物和反应条件未列出):
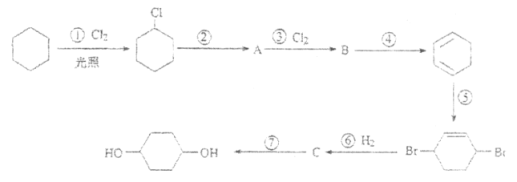
(1)写出反应④、⑦的化学方程式:
④__________________________________;
⑦__________________________________。
(2)上述七个反应中属于加成反应的有____________(填反应序号),A中所含有的官能团名称为____________。
(3)反应⑤中可能产生一定量的副产物,其可能的结构简式为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com