
【题目】(1)古代锻造刀剑时,将炽热的刀剑快速投入水中“淬火”,反应为:3Fe+4H2O(g)![]() Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
Fe3O4+4H2。该反应中H2O作__________(填“氧化剂”或“还原剂”);
(2)检验某溶液中是否含有SO42-,先加盐酸,再加______(填“BaCl2”或“NaCl;
(3)海水提镁的重要步骤之一是用沉淀剂将海水中的Mg2+沉淀。该沉淀剂是__________(填“生石灰”或“盐酸”)。
(4)过氧化钠可用于呼吸面具中作为氧气的来源。完成下列化学方程式:2Na2O2 + 2______ = 2Na2 CO3 +O2 ↑;
(5)某同学炒菜时发现,汤汁溅到液化气的火焰上时,火焰呈黄色。据此他判断汤汁中含有________(填“钠”或“钾”)元素;
【答案】氧化剂 BaCl2 生石灰 CO2 钠
【解析】
(1)在3Fe+4H2O(g)![]() Fe3O4+4H2中氢元素的化合价从+1价降为0价,则H2O作氧化剂;
Fe3O4+4H2中氢元素的化合价从+1价降为0价,则H2O作氧化剂;
(2)检验某溶液中是否含有SO42-,先加稀盐酸,可以排除银离子与碳酸根离子等离子的干扰,再加入BaCl2溶液,产生的沉淀是硫酸钡;
(3)海水中的Mg2+沉淀是生成Mg(OH)2,沉淀剂是利用生石灰与水反应生成氢氧化钙,从而将Mg2+沉淀;
(4)过氧化钠可用于呼吸面具中作为氧气的来源,是利用Na2O2与CO2或水蒸气反应生成氧气,则2Na2O2 + 2CO2= 2Na2 CO3 +O2 ↑;
(5)钠元素的焰色反应呈黄色,即可判断汤汁中含有钠元素。


科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为__。
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入__以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__(填序号);向②中加入足量氯化银后,氯离子的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用NO、O2和Na2CO3溶液反应制备NaNO2的装置如图所示,下列关于该装置的描述不正确的是( )
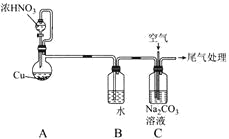
A.装置A分液漏斗中的药品选用不当,应选用稀HNO3
B.实验过程中,通过控制分液漏斗的活塞控制气流速度
C.装置C中发生反应的化学方程式为2Na2CO3+4NO+O2=4NaNO2+2CO2↑
D.实验过程中,装置C液面上方可能出现红棕色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 2CH3OH(g)![]() C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是
C2H4(g)+2H2O(g)。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同种催化剂, 不同温度得到如下图像, 则下列结论不正确的是

A. 一段时间后甲醇反应率下降可能是催化剂活性下降
B. 综合图 1、 图 2 可知, 甲醇还发生了其他反应
C. 若改变甲醇蒸气的流速, 不会影响甲醇反应率和乙烯产率
D. 制乙烯比较适宜的温度是 450℃左右
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA与2molB发生反应A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法不正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法不正确的是
A.平衡时,A和B的转化率相等
B.若 x=1,容器中压强不变时不能判断反应达到平衡
C.当B和D的物质的量之比1:1不变时,表明该反应已达到平衡
D.达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国对环境问题的重视,碳、氮及其化合物的研究备受关注。
已知:Ⅰ![]()
![]() ;
;
Ⅱ![]()
![]() ;
;
Ⅲ![]()
![]()
![]() .
.
请回答下列问题:
(1)![]() ________。
________。
(2)一定温度下,向刚性容器中充入![]() 和足量
和足量![]() ,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。
,发生上述反应,部分物质的物质的量浓度随时间的变化情况如图所示。

![]() 已知曲线a代表
已知曲线a代表![]() 的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
的浓度变化,曲线b代表NO的浓度变化,则曲线c代表________的浓度变化。
![]() 该刚性容器的容积为________;
该刚性容器的容积为________;![]() 内,
内,![]() 的消耗速率
的消耗速率![]() ________。
________。
![]() 该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________
该条件下,反应Ⅰ和反应Ⅱ中活化能较大的是________![]() 填“反应Ⅰ”或“反应Ⅱ”
填“反应Ⅰ”或“反应Ⅱ”![]() ,原因为________。
,原因为________。
![]() 该温度下,反应Ⅲ的化学平衡常数
该温度下,反应Ⅲ的化学平衡常数![]() Ⅲ
Ⅲ![]() ________。
________。
(3)若其他条件不变,将恒温容器改为绝热容器,再次达到平衡后,与原平衡相比,CO的体积分数________![]() 填“增大”“减小”或“不变”
填“增大”“减小”或“不变”![]() ,原因为________。
,原因为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)![]() 2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
2Z(g),经12s达到平衡,生成0.6molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为1/8mol/(L·S)
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的1/5
C.若增大X的浓度,则物质Y的转化率减小
D.若该反应的△H<0 ,升高温度,平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质易溶于水的是________,易溶于CCl4的是________。(均填编号)
①NH3 ②CH4 ③![]() ④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧H2S
④HCl ⑤C2H4 ⑥Br2 ⑦HNO3 ⑧H2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com