
| A. | 采用加热蒸干高锰酸钾溶液的方法获得高锰酸钾晶体 | |
| B. | 过滤时,为了加快过滤速率,可用玻璃棒在漏斗内搅拌 | |
| C. | 用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体 | |
| D. | 某无色溶液中加入稀盐酸无现象,再加Ba(NO3)2溶液,产生白色沉淀,则原溶液中一定有SO42- |
分析 A.加热蒸干高锰酸钾溶液,高锰酸钾分解;
B.玻璃棒在漏斗内搅拌,易捣破滤纸;
C.二者溶解度受温度影响不同;
D.检验硫酸根离子,使用氯化钡.
解答 解:A.加热蒸干高锰酸钾溶液,高锰酸钾分解,应冷却结晶获得高锰酸钾晶体,故A错误;
B.玻璃棒在漏斗内搅拌,易捣破滤纸,则过滤时不能搅拌,故B错误;
C.二者溶解度受温度影响不同,则用冷却结晶法提纯含有少量氯化钠杂质的硝酸钾固体,故C正确;
D.检验硫酸根离子,使用氯化钡,酸性条件下亚硫酸根离子与硝酸根离子可发生氧化还原反应,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、离子检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
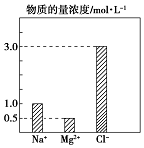 某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:
某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有Fe3+、Ba2+、H+、SO42-、CO32-.为了进一步确认,对该溶液进行实验检测:| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 仔细观察坐标图 | 肯定无 CO32- | 肯定无该离子的理由碳酸根离子和镁离子之间会反应 |
| 步骤二 | 该溶液呈无色、透明、均一状态 | 肯定无 Fe3+ | 肯定无该离子的理由该离子为黄色 |
| 步骤三 | 加入足量BaCl2溶液,生成23.3g白色沉淀,再加稀硝酸,沉淀不消失 | 肯定有SO42-、H+;肯定无Ba2+ | 肯定有H+的理由电荷守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
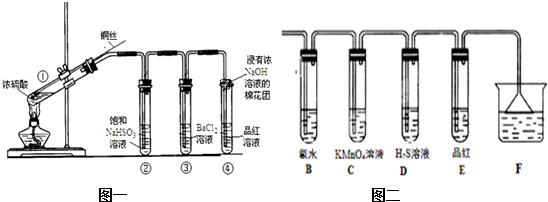
 某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.
某课外小组利用下列装置,对浓硫酸与乙醇反应的可能产物进行了如下探究.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com