
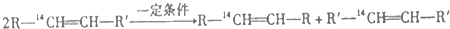
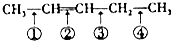
 反应时断裂的化学键应是( )
反应时断裂的化学键应是( )| A. | ①③ | B. | ①④ | C. | ② | D. | ②③ |
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:选择题
| A. | CSO的电子式: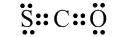 | B. | 二氧化碳的结构式:O-C-O | ||
| C. | 中子数为45的溴原子:3545Br | D. | Cl-离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
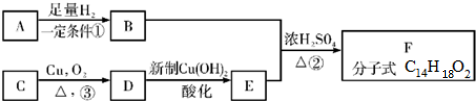
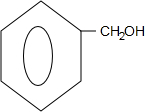 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$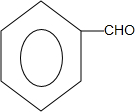 +2H2O;
+2H2O;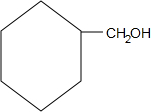 +
+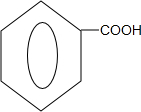 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$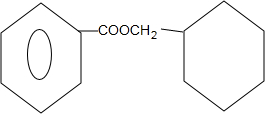 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜作电极电解Na2SO4溶液:Cu+2H+$\frac{\underline{\;通电\;}}{\;}$Cu2++H2↑ | |
| B. | NH4Al(SO4)2溶液与过量稀氨水反应:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 用稀硝酸清洗试管内壁的银镜:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 过量氯气通入碘化亚铁溶液中:2Cl2+2Fe3++2I=4Cl-+2Fe3++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是:a>c>b | |
| B. | 常温下,浓度均为0.1mol/L ①醋酸、②盐酸、③醋酸钠溶液,水的电离程度由大到小的顺序为:③>①>② | |
| C. | 物质的浓度相同的:①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH由大到小的顺序为:③>①>② | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| B. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| C. | 常温下浓硫酸使铝钝化,可在常温下用铝制贮罐贮运浓硫酸 | |
| D. | 二氧化氮溶于水时只生成唯一产物硝酸,工业上利用这一原理生产硝酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com