
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是( )

A.分子中的官能团有羟基、碳碳双键、醚键、酯基
B.若R为乙基则该物质的分子式可以表示为C16H14O7
C.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.lmol该化合物最多可与7mol Br2完全反应
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】为减少雾霾天气,大容量的镍氢电池已经开始用于汽油/电动混合动力汽车上。镍氢电池放电时的电极反应为:H2+2OH--2e-=2H2O,NiO(OH)+H2O+e-=Ni(OH)2+OH-。下列说法正确的是
A.电池放电时,H2发生还原反应B.电池放电时,Ni(OH)2发生氧化反应
C.电池充电时,H2O发生还原反应.D.电池充电时,NiO(OH)发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)欲从苯酚的乙醇溶液中回收苯酚,有下列操作,合理的顺序是 (填字母)。
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤通入过量CO2
⑥加入足量NaOH 溶液 ⑦加入足量FeCl3溶液 ⑧加入足量浓溴水
A. ⑧ ② B.⑥ ① ⑤ ③ C.④② D.⑦ ① ③
(2)下列说法正确的是 (填序号)。
①麦芽糖及其水解产物均能发生银镜反应,且试管内壁的银镜需用稀氨水洗涤
②蛋白质溶液中加入饱和硫酸铵溶液,有沉淀析出,加水后沉淀也不溶解
③淀粉液中加入几滴稀硫酸加热几分钟,冷却后加入银氨溶液并水浴加热,没有观察到银镜现象,证明淀粉未发生水解
④只用溴水就能鉴别四氯化碳、甲苯、乙烯、乙醇
Ⅱ已知:CH3CH2OH+NaBr+H2SO4(浓) ![]() CH3CH2Br+NaHSO4 +H2O。
CH3CH2Br+NaHSO4 +H2O。
实验室制备溴乙烷(沸点为38.4℃)的装置如图:圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的10.3g溴化钠和几粒碎瓷片,小火加热,使NaBr充分反应。
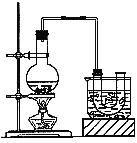
(1)反应时若温度过高会降低溴乙烷的产率,原因是 ;也可看到有红棕色气体产生,该气体的化学式为 。为避免温度过高,宜采用 加热。
(2)反应结束后,U形管中粗制的溴乙烷呈棕黄色。为了除去其中的杂质,最好选用下列试剂中的
(填序号)。
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(3)溴乙烷在NaOH水溶液和NaOH乙醇溶液发生不同类型的反应,生成不同的产物,用右图所示装置进行实验:该实验的目的是 。 盛水的试管(装置)的作用是 。
(4)为检验溴乙烷中的溴元素,正确的操作顺序是:取少量溴乙烷,然后 (填序号)。
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却
(5)经提纯最终得到纯净的溴乙烷为7.63g,则溴乙烷的产率为 (保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为( )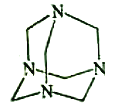
A. 1:1 B. 2:3 C. 3:2 D. 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】原子序数依次增大的A、B、C、D、E、F六种元素。其中A的基态原子有3个不同的能级,各能级中的电子数相等;C的基态原子2p能级上的未成对电子数与A原子的相同;D为它所在周期中原子半径最大的主族元素;E和C位于同一主族,F的原子序数为29。
(1)F原子基态的外围核外电子排布式为 。
(2)在A、B、C三种元素中,第一电离能由小到大的顺序是 (用元素符号回答)。
(3)元素B的简单气态氢化物的沸点 (高于,低于)元素A的简单气态氢化物的沸点,其主要原因是 。
(4)由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-的结构式为 。
(5)在元素A与E所形成的常见化合物中,A原子轨道的杂化类型为 。
(6)由B、C、D三种元素形成的化合物晶体的晶胞如图所示,则该化合物的化学式为 。
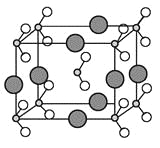
(7)FC在加热条件下容易转化为F2C,从原子结构的角度解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四苯基乙烯(TPE)及其衍生物具有聚集诱导发光特性,在光电材料等领域应用前景广阔。以下是TPE的合成路线(部分试剂和反应条件省略):
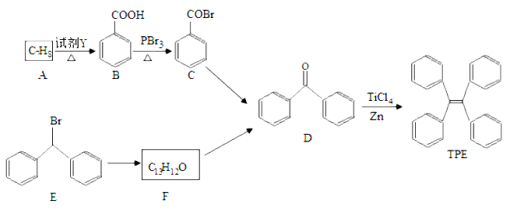
(1)A的名称是 ;试剂Y为 。
(2)B→C的反应类型是 ;B中官能团的名称是 ; D中官能团的名称 。
(3)E→F的化学方程式是 。
(4)W是D的同分异构体,具有下列结构特征:属于萘(![]() )的一元取代物;存在羟甲基(—
)的一元取代物;存在羟甲基(—
CH2OH)。写出W所有可能的结构简式: 。
(5)下列说法正确的是 ( )
a.B的酸性比碳酸强 b.D不能发生还原反应
c.E含有3种不同化学环境的氢 d.TPE既属于芳香烃也属于烯烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护环境,科学家们着力研究大气污染物的治理。
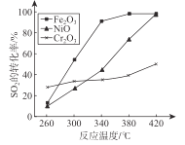
(1)治理含CO、SO2的烟道气以Fe2O3做催化剂,将CO、SO2在380℃时转化为S和一种无毒气体。已知:①硫的熔点:112.8℃、沸点:444.6℃;于反应每得到mol硫,放出 270kJ的热量。写出该治理烟道气反应的热化学方程式____________________________________;其他条件相同、催化剂不同时,上述反应中SO2的转化率随反应温度的变化如图所示,不考虑催化剂价格因素,生产中选Fe2O3做催化剂的主要原因是 ____________________________________;
(2)在450℃,并有V2O5的催化剂存在下SO2能转化为SO3:2SO2(g)+O2 (g)![]() 2SO3(g) △H= -190kJ·mol -1;已知单质硫的燃烧热为296kJ·mol -1,则 S(s)+
2SO3(g) △H= -190kJ·mol -1;已知单质硫的燃烧热为296kJ·mol -1,则 S(s)+![]() O2(g)
O2(g)![]() SO3(g) △H=___kJ·mol -1 。在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O =2nCuSO4 +(2-2n)H2SO4 从环境保护的角度看,催化脱硫的意义为__________;每吸收标准状况下11.2 LSO2,被SO2还原的O2的质量为__________g。
SO3(g) △H=___kJ·mol -1 。在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:2SO2+2nCu+(n+1)O2+(2-2n)H2O =2nCuSO4 +(2-2n)H2SO4 从环境保护的角度看,催化脱硫的意义为__________;每吸收标准状况下11.2 LSO2,被SO2还原的O2的质量为__________g。
(3)在一个固定容积为5L的密闭容器中充0.20molSO2和0.10molO2,在450℃并有催化剂条件下,半分钟后达到平衡,测得容器中含SO30.10 mol,则V(O2)=______(mol·L -1·min -1 );放出的热量为______kJ;该温度下的平衡常数为________;若继续通入0.20 molSO2和0.10mol O2,则再次平衡时,二氧化硫的转化率________(选填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:
![]()
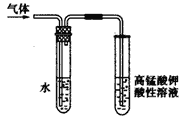
(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
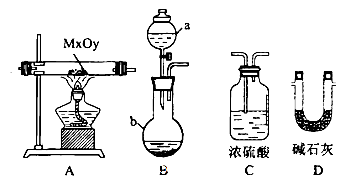
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________ (用含X、y、m、n的式子表示)。
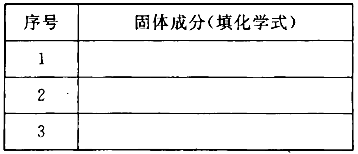
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
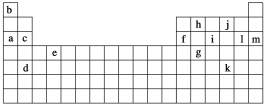
(1)下列______(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
a.原子核对核外电子的吸引力 b.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
锂 | X | Y | |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 | 9 550 | 11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量?__________________________________________。
②表中X可能为以上13种元素中的________(填写字母)元素。用元素符号表示X和j形成化合物的化学式_________。
③Y是周期表中的______族元素。
④以上13种元素中,______(填写字母)元素原子失去核外第一个电子所需要的能量最多。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com