
| A.0.1mol/L | B.0.2mol/L |
| C.0.6mol/L | D.0.4mol/L |
科目:高中化学 来源:不详 题型:单选题
| A.物质和氧气发生的反应一定属于化合反应 |
| B.有盐和水生成的反应不一定是中和反应 |
| C.分子在化学反应前后一定不变 |
| D.pH>7的溶液一定是碱的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
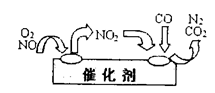
 CO2+N2,其中NO2是
CO2+N2,其中NO2是| A.氧化剂 | B.还原剂 |
| C.既是氧化剂又是还原剂 | D.既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.现榨的苹果汁具有氧化性 | B.现榨的苹果汁具有还原性 |
| C.棕黄色为Fe2+的特征色 | D.维生素C具有抗还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化剂 | B.还原剂 | C.催化剂 | D.溶剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

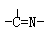 三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。
三种基团,无环状结构,三种基团的数目关系为n3= 。若A的相对分子质量为116,上述基团连接时碳原子跟碳原子相连,则A的结构简式是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com