
【题目】用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则下列说法正确的是( )
A.电解过程中阴极没有气体生成
B.电解过程中转移的电子的物质的量为0.4 mol
C.原CuSO4溶液的浓度为0.1 mol·L-1
D.电解过程中阳极收集到的气体体积为1.12 L(标况下)
【答案】B
【解析】
试题分析:Cu(OH)2从组成上可看成CuOH2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+2CuSO4![]() 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
2H2O![]() 2H2↑+O2↑转移电子
2H2↑+O2↑转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
A、根据以上分析,阴极有氢气放出,故A错误;B、根据以上分析计算,电解过程中共转移电子为0.4 mol,故B正确;C、没有体积无法计算,故C错误;D、根据以上分析,阳极收集到的气体体积为(0.05+0.05)×22.4=2.24L,故D错误;故选B。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A. 所得溶液中的c(H+)=1.0×10-13mol·L-1
B. 所得溶液中由水电离产生的c(OH-)=1.0×10-13mol·L-1
C. 所加的烧碱溶液pH=13
D. 所得溶液中的c(Mg2+)=5.6×10-10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡,根据要求回答下列问题:
(1)向 ZnSO4溶液中滴加饱和H2S溶液,没有沉淀生成,继续滴加一定量的氨水后,生成ZnS沉淀,用电离平衡原理解释上述现象 _______________________________________________ 。
(2)AlCl3溶液蒸干并灼烧得到的物质是__________ (填化学式)。
(3)0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为_____________。
(4)0.1mol·L-1的NaHA溶液中,粒子浓度由大到小的顺序为:c(Na+)>c(HA—)>c(H2A)>c(A2-)
①该溶液中显________(填“酸性”、“碱性”或“中性”);
②作出上述判断的依据是___________________________________________(用文字解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是298K时,N2与H2反应过程中能量变化的曲线图,下列叙述不正确的是

A. 在温度、体积一定的条件下,通入1mol N2和3mol H2 反应后放出的热量为92kJ
B. a曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,也不能提高N2的转化率
D. 该反应的热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=﹣92 kJ/mol
2NH3(g) △H=﹣92 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.2H2(g)+O2(g)=2H2O(1) △H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
(2) 以KOH溶液为电解质溶液,依据题(1)所选反应设计一个原电池,其负极的电极反应式为_______。

(3) 电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与右图中电解池相连,其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为___________________。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672 mL(标准状况下)时,溶液的c(H+) = _____(假设电解后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓盐酸与高锰酸钾发生反应快速制备氯气。化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(1)用单线桥法表示该反应过程中的电子转移情况。________________,该反应中HCl被氧化和未被氧化的物质的量之比为________。
(2)下列装置为实验室制备氯气的装置。
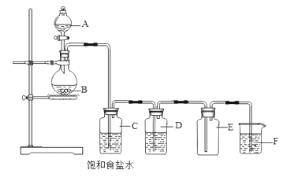
装置C的作用是______________________,装置E的作用是_______________________________。装置F中的试剂是_________________。
(3)写出F中发生的离子反应方程式________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在配制Na2S溶液时,为了抑制水解,可以加入少量的________(填化学式);其水解的离子方程式为____________。
(2)0.1 mol/L的NaHCO3溶液的pH为8,同浓度的AlCl3溶液的pH为4。将两种溶液等体积混合,可能发生的现象是____________________________其主要原因是(用离子方程式表示) ______________________________。
(3)明矾常作净水剂,其净水原理用离子方程式可表示为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
①0.1mol·L-1 氨水中,c(OH-)=c(NH 4+)
②10mL 0.02mol·L-1 HCl 溶液与 10mL0.02mol·L-1Ba(OH)2 溶液充分混合,若混合后溶液的体积为 20mL,则溶液的 pH=12
③在 0.1mol·L-1 CH COONa 溶液中,c(OH-)=c(CH COOH)+c(H+)
④0.1mol·L-1 某二元弱酸酸式盐 NaHA 溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H A)
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组欲探究Cl2与KI溶液的反应,设计实验装置如图。

已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大,其原因为I2(s)+I-(aq)![]() I3-(aq)
I3-(aq)
完成下列填空:
(1)仪器A使用前必须进行的操作是___________,仪器B的名称是___________。
(2)该实验设计装置存在明显缺陷是___________,改进之后,进行后续实验。
(3)C中的试剂是___________;当E装置中出现___________时,停止加热。
(4)当氯气开始进入D时,D中看到的现象是____________;不断向D中通入氯气,看到溶液颜色逐渐加深,后来出现深褐色沉淀,试运用平衡移动原理分析产生这些现象的原因_____。
(5)持续不断地向D中通入氯气,看到D中液体逐渐澄清,最终呈无色。实验小组猜想,D中无色溶液里的含碘物质可能是HIO3。
①按照实验小组的猜想,用化学方程式解释“D中液体逐渐澄清,最终呈无色”的原因_____。
②为了验证猜想是否正确,实验小组又进行如下实验:
ⅰ.取反应后D中溶液5.00mL(均匀)于锥形瓶中,加入KI(过量)和足量稀硫酸。
ⅱ.向上述锥形瓶中滴加淀粉指示剂,溶液变蓝,用0.6250mol/L的Na2S2O3溶液滴定至蓝色刚好褪去,消耗Na2S2O3溶液VmL。
已知:2HIO3+10KI+5H2SO4=6I2+5K2SO4+6H2O、I2+2S2O32-=2I-+S2O62-,若V=___________时,说明实验小组的猜想正确。
(6)欲检验某溶液中是否含有I-,可使用的试剂为溴水和四氯化碳。合理的实验操作为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com