
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Cl2有氧化性 | Cl2能使湿润的红色布条褪色 |
| B | SO2有漂白性 | SO2能使酸性KMnO4溶液褪色 |
| C | Al有还原性 | 利用铝热反应冶炼金属Mn |
| D | Fe3+有氧化性 | Fe3+遇KSCN溶液显血红色 |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
“辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料,钢铁在潮湿空气中易发生 (填“化学”或“电化学”)腐蚀。请列举两种防止钢铁腐蚀的方法: 、 。人类最早使用的合金材料是 (填字母)。

A.铁合金 B.铝合金 C.铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
用48mL0.1mol·L-1FeSO4溶液恰好能还原2.4×10-3mol[RO(OH)2]+,则反应后R元素的化合价为 ( )
A.+2 B.+3 C.+4 D.+5
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g) + bB(g)  cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
cC(g) + dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是( )
A、达平衡后,若升温,平衡左移
B、达平衡后,加入催化剂则C%增大
C、化学方程式中a+b>c+d
D、达平衡后,减少A的量有利于平衡向右移动

查看答案和解析>>
科目:高中化学 来源: 题型:
根据化学学科中的基本理论,请回答下列问题:
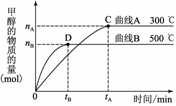 I、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。
I、常温下,取pH=2的盐酸和醋酸溶液各100 ml, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是_____ (填“A”或“B”)。
II、丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
 已知:
已知:
(1)写出丙烷的燃烧热的热化学方程式:
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
①下列事实能说明该反应达到平衡的是
a.体系中的压强不发生变化 b.v正(H2) = v逆(CO)
c.混合气体的平均相对分子质量不发生变化 d.CO2的浓度不再反生变化
②5min后体系达到平衡,经测定,H2为0.8mol,则v(H2)= 。
③向平衡体系中充入少量CO,则平衡常数 (填“增大”、“减小”或“不变”)。
(3)依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移
向 极(填“正”或“负”);电池的正极电极反应为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于常温下pH=3的乙酸溶液,下列说法正确的是
A.与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH升高
D.溶液中粒子浓度大小关系为: c(H+)>c(CH3COOH) > c(CH3COO-)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.加入铝粉能放出氢气的溶液中:CO32—、AlO2—、I—、NO3—
B.由水电离出的c(OH—)=10—13 mol·L—1的溶液中:Fe3+、NH4+、ClO—、Cl—
C.使pH试纸变红的溶液中:NH4+、Cu2+、SO42—、Cl—
D.能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2—、Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。
2xCO+2NOx ==2xCO2+N2
当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g)  CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:①CO(g)+2H2(g) CH3OH(g) △H=-90.7 kJ·mol-1
CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)的△H= 。
CH3OCH3(g)+CO2(g)的△H= 。
(3)CO—空气燃料电池中使用的电解质是搀杂Y2O3的ZrO2晶体,它在高温下能传导O2—。
该电池负极的电极反应式为 。
(4)甲醇也是新能源电池的燃料,但它对水质会造成一定的
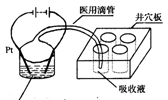 污染。有一种电化学法可消除这种污染。其原理是:2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧
污染。有一种电化学法可消除这种污染。其原理是:2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧 化成CO2而净化。实验室用右图装置模拟上述过程:
化成CO2而净化。实验室用右图装置模拟上述过程:
①检验电解时产生的CO2气体,井穴板穴孔内应盛放 溶液。
②写出净化甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:


(1)乙中含有的官能团的名称为____________________。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):

其中反应I的反应类型是_______________,反应II的条件是___________________
(3)由甲出发合成丙的路线之一如下:

①下列物质不能与B反应的是 (选填序号)。
a.金属钠 b.FeCl3 c.碳酸钠溶液 d.HBr
②丙的结构简式为 。
③写出反应③的化学方程式为
④写出D符合下列条件的所有同分异构体的结构简式 。
a.苯环上的一氯代物有两种 b.遇FeCl3溶液发生显色反应 c.能与Br2/CCl4溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com