

分析 (1)最简单的有机物为甲烷,CH3-CH3为乙烷;
(2)可以从石油获得的基本化工原料且可以做水果催熟剂的有机物为乙烯;
(3)乙醇可被氧化生成乙酸,乙酸、乙醇发生酯化反应;
(4)水与乙醇相比较,水与钠反应剧烈;
(5)乙酸含有羧基;
(6)毛发、皮、丝、酶的主要成分是蛋白质;
(7)淀粉水解的最终产物是葡萄糖;
(8)石油催化裂化可提高汽油的质量和产量.
解答 解:(1)最简单的有机物为甲烷,CH3-CH3为乙烷,故答案为:CH4;乙烷;
(2)可以从石油获得的基本化工原料且可以做水果催熟剂的有机物为乙烯,故答案为:乙烯;
(3)红葡萄酒密封储存时间越长,质量越好,原因是乙醇可被氧化生成乙酸,乙酸、乙醇发生酯化反应,故答案为:乙酸乙酯;酯化;
(4)水与乙醇相比较,水与钠反应剧烈,故答案为:水;
(5)乙酸含有羧基,具有酸性,可与碳酸钠等反应,故答案为:羧基;
(6)毛发、皮、丝、酶的主要成分是蛋白质,故答案为:蛋白质;
(7)淀粉水解的最终产物是葡萄糖,故答案为:葡萄糖;
(8)石油催化裂化可提高汽油(煤油、柴油)的质量和产量,故答案为:汽油(煤油、柴油).
点评 本题考查有机物的结构和性质,为高频考点,侧重于有机物的组成、应用以及性质的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


 作业辅导系列答案
作业辅导系列答案科目:高中化学 来源: 题型:推断题
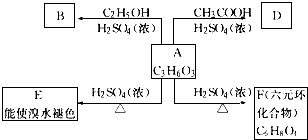
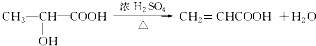 ;A→F
;A→F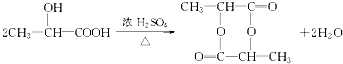
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
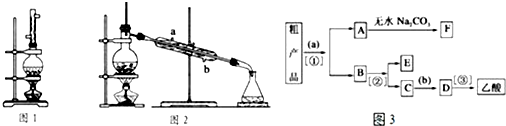
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 58.5 g的氯化钠固体中含有NA个氯化钠分子 | |
| B. | 标准状况下,5.6 L一氧化氮和5.6 L氧气混合后的分子总数为0.5NA | |
| C. | 0.1 mol•L-1氢氧化钠溶液中含钠离子数为0.1NA | |
| D. | 5.6 g铁与足量稀硫酸反应时失去电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6gCH4中含有的分子数 | |
| B. | 100 mL1mol/LH2SO4中含有的H+ 数 | |
| C. | 2.4gMg中含有的原子数 | |
| D. | 标准状况下,22.4LCO气体中含有的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
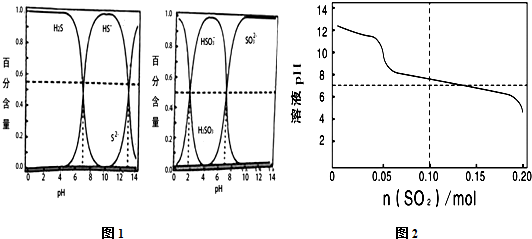
| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Al3+、SO42-、NO3- | B. | K+、Na+、S2-、Cl- | ||
| C. | K+、NH4+、MnO4-、SO42- | D. | Na+、K+、NO3-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com