
已知A、B、C、D、E五种元素的性质或结构信息如下,请根据信息回答下列问题:
(1)已知短周期元素A、B原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |


(1)①能量最低原理(2分) ②sp(2分) 直线(2分)
(2)①1s22s22p63s23p63d104s1或[Ar]3d104s1(2分)
②Al-3e-+4OH-=AlO2-+2H2O(2分) ③8;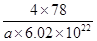 (3分)
(3分)
解析试题分析:(1)A的第三电离能比第二电离能大很多,这说明A很难失去3个电子,因此A应该是第ⅡA族元素。同样B的第三电离能比第二电离能大很多,即B也很难失去3个电子,因此B是第ⅡA族元素。 同主族自上而下金属性逐渐增强,第一电离能逐渐减小,则A是Be,B是Mg。
①根据核外电子排布规律可知,只有排满了3s才能排3p,所以该示意图违背了能量最低原理。
②BeCl2分子中Be含有的孤电子对数是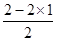 =0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
=0,即不含有孤对电子,因此Be的价层电子对数是2,属于sp杂化,空间构型为直线形。
(2)C单质曾被称为“银色的金子”,与锂形成的合金常用于航天飞行器,其单质能溶于强酸和强碱,因此C是铝。D是周期表中电负性最大的元素,则D是F。E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物,则E是Cu。
①根据核外电子排布规律可知铜元素原子基态时的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1。
②以C单质、镁、NaOH溶液可以构成原电池,由于铝能与氢氧化钠溶液反应,而镁不能,因此负极是铝,镁是正极,则负极的电极反应式为Al-3e-+4OH-=AlO2-+2H2O。
③根据晶胞结构可知,钙离子周围与钙离子最近的氟离子有8个(每个面被2个立方体共用),则Ca2+离子的配位数为8。晶胞中含有该离子的个数是8× +6×
+6× =4,氟离子是8个,因此
=4,氟离子是8个,因此 ×6.02×1023=4,解得V=
×6.02×1023=4,解得V= cm3。
cm3。
考点:考查元素推断、电离能、核外电子排布、杂化轨道、空间构型、原电池以及晶胞结构与计算


科目:高中化学 来源: 题型:单选题
2011年诺贝尔化学奖授予以色列科学家达尼埃尔·谢赫特曼,以表彰他发现了准晶体。准晶体材料具有硬度高,不易损伤,使用寿命长等特点。下列叙述错误的是( )
| A.自然界中的固体可分为晶体、准晶体和非晶态物质 |
| B.准晶体是一种介于晶体和非晶态物质之间的固体 |
| C.准晶体材料的应用具有较大的发展空间 |
| D.化学式为Al63Cu24Fe13的准晶体不可与稀硝酸发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
最近,美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法正确的是( )
A.CO2的原子晶体中存在范德华力,每1molCO2原子晶体中含有2NA 键
键
B.在一定条件下,CO2原子晶体转化为分子晶体CO2是物理变化
C.熔点:金刚石>原子晶体CO2>SiO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各项中所描述的两个量,前者一定大于后者的是
| A.NaCl晶体和晶体NaF的晶格能 |
B.等物质的量的CO2分子和分子CH2=CH2中 键的数目 键的数目 |
| C.等物质的量的SO2和O2在一定条件下反应,SO2与O2的转化率 |
| D.25℃时pH=11的NaOH溶液和pH=11的Na2CO3溶液中的H+的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,
具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们
的晶体结构如图所示。
(1)关于这两种晶体的说法,正确的是 (填序号)。
| A.立方相氮化硼含有σ键和π键,所以硬度大 |
| B.六方相氮化硼层间作用力小,所以质地软 |
| C.两种晶体中B-N键均为共价键 |
| D.两种晶体均为分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有。金原子的直径为d,用NA表示阿伏加德罗常数,M表示金的摩尔质量。
(1)金晶体每个晶胞中含有________个金原子。
(2)欲计算一个晶胞的体积,除假定金原子是刚性小球外,还应假定____________。
(3)一个晶胞的体积是__________。
(4)金晶体的密度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
硼元素在化学中有很重要的地位。硼的化合物在农业、医药等方面用途很广。请回答下列问题:
(1)写出与B元素同主族的Ga元素的基态原子核外电子排布式________________________________________________________________________。
从原子结构的角度分析,B、N、O元素的第一电离能由大到小的顺序为________。
(2)立方氮化硼可利用人工方法在高温高压条件下合成,属于超硬材料。同属原子晶体的氮化硼(BN)比晶体硅具有更高硬度和耐热性的原因是________________________________________________________________________________________________________________________________________________。
(3)在BF3分子中中心原子的杂化轨道类型是________,SiF4粒子的空间构型是________。又知若有d轨道参与杂化,能大大提高中心原子成键能力。试解释为什么BF3、SiF4水解的产物中,除了相应的酸外,前者生成BF4-后者却是生成SiF62-:________________________________________________________________________
________________________________________________________________________。
(4)科学家发现硼化镁在39 K时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。根据图示确定硼化镁的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
大气污染问题已成影响环境的重要因素,有人想利用2CO(g)+SO2(g) 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是 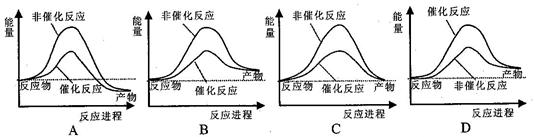
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
如图是CsCl晶体的晶胞结构(晶体中最小重复单元),已知晶体中两个最近的Cs+核间距离为a cm,氯化铯的式量为M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )。
A. g·cm-3 g·cm-3 | B. g·cm-3 g·cm-3 |
C. g·cm-3 g·cm-3 | D. g·cm-3 g·cm-3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com