
ΓΨΧβΡΩΓΩΡ≥–ΘΧΫΨΩ–‘―ßœΑ–ΓΉι”Ο“―≤ΩΖ÷…ζ–βΒΡΖœΧζ–Φ÷ΤΉς”ΓΥΔΒγ¬ΖΑεΒΡΗ· ¥ΦΝΘ§≤ΔΜΊ ’Ά≠ΓΘΧΫΨΩΙΐ≥Χ»γœ¬ΘΚ
«κΜΊ¥πœ¬Ν–Έ ΧβΘΚ
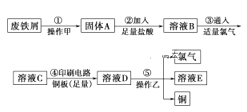
Θ®1Θ©≤Ϋ÷ηΔΌ÷–œ»Φ”»κ»»ΒΡNa2CO3»ή“Κ≥ΐ”ΆΈέΘ§≤ΌΉςΦΉΒΡΟϊ≥Τ «_____ΓΘ
Θ®2Θ©≤Ϋ÷ηΔΎ÷–Θ§≥ΐΖΔ…ζΖ¥”ΠFeΘΪ2HCl=FeCl2ΘΪH2ΓϋΆβΘ§ΤδΥϊΩ…ΡήΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣFe2O3ΘΪ6HΘΪ=2Fe3ΘΪΘΪ3H2OΚΆ____ΓΘ
Θ®3Θ©»ή“ΚCΒΡ―’…Ϊ «____Θ§»ή“ΚD÷–Ω…ΡήΚ§”–ΒΡΫπ τ―τάκΉ””–___ΓΘ
Θ®4Θ©Ω…“‘―ι÷Λ»ή“ΚB÷– «ΖώΚ§”–Fe2ΘΪΒΡ“Μ÷÷ ‘ΦΝ «____(Χν―Γœν–ρΚ≈)ΓΘ
aΘ°œΓΝρΥα bΘ°Χζ cΘ°Νρ«ηΜ·ΦΊ dΘ°Υα–‘ΗΏΟΧΥαΦΊ»ή“Κ
Θ®5Θ©≤ΌΉς““ΒΡΟϊ≥Τ «___Θ§≤Ϋ÷ηΔί≤ζ…ζΫπ τΆ≠ΒΡΜ·―ßΖΫ≥Χ ΫΈΣ____ΓΘ
ΓΨ¥πΑΗΓΩΙΐ¬Υ Fe+2Fe3+=3Fe2+ ΉΊΜΤ…Ϊ Fe2+ΓΔCu2+ΓΔFe3+ d ΒγΫβ CuCl2![]() Cu+Cl2ΓϋΓΘ
Cu+Cl2ΓϋΓΘ
ΓΨΫβΈωΓΩ
ΖœΧζ–ΦΨ≠ΔΌΦ”»κ»»ΒΡNa2CO3»ή“Κ≥ΐ”ΆΈέΘ§Ψ≠ΙΐΙΐ¬Υ≤ΌΉςΩ…ΒΟΒΫΙΧΧεAΘ§Φ”»κ―ΈΥαΘ§ΖΔ…ζFe2O3+6H+=2Fe3++3H2OΘ§Fe+2Fe3+=3Fe2+»ΜΚσΆ®»κ ΝΩΒΡ¬»ΤχΘ§ΖΔ…ζ2Fe2++Cl2=2Fe3++2Cl-Θ§»ή“ΚCΈΣFeCl3Θ§”Ο”ΎΗ· ¥”ΓΥΔΒγ¬ΖΘ§ΖΔ…ζCu+2Fe3+=2Fe2++Cu2+Ά®ΙΐΒγΫβ≤ΌΉς““Ω…ΒΟΒΫ¬»ΤχΓΔΆ≠ΚΆEΘ§Υυ“‘―τΦΪ…ζ≥…¬»ΤχΘ§“θΦΪ…ζ≥…Ά≠Θ§ΉνΚσΒΟΒΫ¬»Μ·―«Χζ»ή“ΚΓΘ
(1)ΖœΧζ–ΦΨ≠ΔΌΦ”»κ»»ΒΡNa2CO3»ή“Κ≥ΐ”ΆΈέΘ§Ω…ΒΟΒΫΙΧΧεAΘ§”ΠΨ≠ΙΐΙΐ¬Υ≤ΌΉςΘ§Ι ¥πΑΗΈΣΘΚΙΐ¬ΥΘΜ
(2)Ψ≠Ιΐ…œ ωΖ÷ΈωΩ…÷ΣΘΚΙΧΧεAΈΣFe2O3ΚΆFeΒΡΜλΚœΈο,Φ”»κ―ΈΥαΖΔ…ζFe2O3+6H+=2Fe3++3H2OΘ§Fe+2Fe3+=3Fe2+ΘΜΙ ¥πΑΗΈΣΘΚFe+2Fe3+=3Fe2+ΘΜ
(3) Ψ≠Ιΐ…œ ωΖ÷ΈωΩ…÷ΣΘΚ»ή“ΚB ΈΣFeCl2ΚΆ FeCl3ΒΡΜλΚœΈοΘ§Ά®»κ ΝΩΒΡ¬»ΤχΘ§ΖΔ…ζ2Fe2++Cl2=2Fe3++2Cl-Θ§Υυ“‘»ή“ΚCΈΣFeCl3Θ§≥ ΉΊΜΤ…ΪΘ§”Ο”ΎΗ· ¥”ΓΥΔΒγ¬ΖΘ§ΖΔ…ζΒΡΖΔ”ΠΈΣΘΚCu+2Fe3+=2Fe2++Cu2+Θ§‘ρ»ή“ΚD÷–Ω…ΡήΚ§”–ΒΡΫπ τ―τάκΉ””–Fe2+ΓΔCu2+ΓΔFe3+Θ§Ι ¥πΑΗΈΣΘΚΉΊΜΤ…ΪΘΜFe2+ΓΔCu2+ΓΔFe3+ΘΜ
(4)“ρΈΣFe2+ΨΏ”–ΜΙ‘≠–‘Θ§Ω… ΙΥα–‘ΗΏΟΧΥαΦΊΆ …ΪΘ§Υυ“‘”ΟΥα–‘ΗΏΟΧΥαΦΊ»ή“ΚΦλ―ιΘ§Ι ¥πΑΗΈΣ:dΘΜ
(5) Ψ≠Ιΐ…œ ωΖ÷ΈωΩ…÷ΣΘΚ»ή“ΚD÷–Κ§”–ΒΡάκΉ”ΈΣFe2+ΓΔCu2+ΓΔFe3+ΓΔCl-ΓΘ≤Ϋ÷ηΔί≤ζ…ζΫπ τΆ≠ΚΆ¬»ΤχΘ§ΤδΒγΫβΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣΘΚCuCl2![]() Cu+Cl2ΓϋΘ§Ι ¥πΑΗΈΣΘΚΒγΫβΘΜCuCl2
Cu+Cl2ΓϋΘ§Ι ¥πΑΗΈΣΘΚΒγΫβΘΜCuCl2![]() Cu+Cl2ΓϋΓΘ
Cu+Cl2ΓϋΓΘ


 –Γ―ßΩΈΧΟΉς“ΒœΒΝ–¥πΑΗ
–Γ―ßΩΈΧΟΉς“ΒœΒΝ–¥πΑΗ Ϋπ≤© Ω“ΜΒψ»ΪΆ®œΒΝ–¥πΑΗ
Ϋπ≤© Ω“ΜΒψ»ΪΆ®œΒΝ–¥πΑΗ
| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩCO2Φ» «Έ¬ “ΤχΧεΘ§“≤ «÷Ί“ΣΒΡΜ·ΙΛ‘≠ΝœΘ§Εΰ―θΜ·ΧΦΒΡ≤ΕΉΫΚΆάϊ”Ο «Έ“ΙζΡή‘¥Νλ”ρΒΡ“ΜΗω÷Ί“Σ’Ϋ¬‘ΖΫœρΓΘ
Θ®1Θ©”ΟΜν–‘ΧΩΜΙ‘≠Ζ®Ω…“‘¥ΠάμΤϊ≥ΒΈ≤Τχ÷–ΒΡΒΣ―θΜ·ΈοΘ§Ρ≥―–ΨΩ–ΓΉιœρΡ≥Οή±’»ίΤςΦ”»κΉψΝΩΒΡΜν–‘ΧΩΚΆ“ΜΕ®ΝΩΒΡNOΘ§ΖΔ…ζΖ¥”ΠC(s)+ 2NO(g) ![]() N2(g)+CO2(g) ΓςHΘ§‘ΎT1Γφ ±Θ§Ζ¥”ΠΫχ––ΒΫ≤ΜΆ§ ±Φδ≤βΒΟΗςΈο÷ ΒΡΝΩ≈®Ε»»γœ¬ΘΚ
N2(g)+CO2(g) ΓςHΘ§‘ΎT1Γφ ±Θ§Ζ¥”ΠΫχ––ΒΫ≤ΜΆ§ ±Φδ≤βΒΟΗςΈο÷ ΒΡΝΩ≈®Ε»»γœ¬ΘΚ
≈®Ε»/(mol/L)/\ ±Φδ/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
ΔΌΗυΨίΆΦ±μ ΐΨίΖ÷ΈωT1Γφ ±Θ§ΗΟΖ¥”Π‘Ύ0ΓΪ10minΡΎΒΡΤΫΨυΖ¥”ΠΥΌ¬ v(N2)ΘΫ____________molΓΛL-1ΓΛmin-1ΘΜΦΤΥψΗΟΖ¥”ΠΒΡΤΫΚβ≥Θ ΐKΘΫ_____________ΓΘ
ΔΎ»τ30minΚσ÷ΜΗΡ±δΡ≥“ΜΧθΦΰΘ§Ψί…œ±μ÷–ΒΡ ΐΨί≈–ΕœΗΡ±δΒΡΧθΦΰΩ…Ρή «____________Θ®ΧνΉ÷ΡΗ±ύΚ≈Θ©ΓΘ
A.Φ”»κΚœ ΒΡ¥ΏΜ·ΦΝ B. Β±Υθ–Γ»ίΤςΒΡΧεΜΐ
C.Ά®»κ“ΜΕ®ΝΩΒΡNO ΓΓ D.Φ”»κ“ΜΕ®ΝΩΒΡΜν–‘ΧΩ
Δέ»τ30minΚσ…ΐΗΏΈ¬Ε»÷ΝT2ΓφΘ§¥οΒΫΤΫΚβ ±Θ§»ίΤς÷–NOΓΔN2ΓΔCO2ΒΡ≈®Ε»÷°±»ΈΣ2ΘΚ3ΘΚ3Θ§‘ρ¥οΒΫ–¬ΤΫΚβ ±NOΒΡΉΣΜ·¬ ___________Θ®ΧνΓΑ…ΐΗΏΓ±ΜρΓΑΫΒΒΆΓ±Θ©Θ§ΓςH______0Θ®ΧνΓΑ>Γ±ΜρΓΑ<Γ±Θ©ΓΘ
Θ®2Θ©ΙΛ“Β…œ”ΟCO2ΚΆH2Ζ¥”ΠΚœ≥…ΕΰΦΉΟ―ΓΘ“―÷ΣΘΚ
CO2(g)ΘΪ3H2(g)![]() CH3OH(g)ΘΪH2O(g) ΓςH1ΘΫ-49.1 kJΓΛmolΘ≠1
CH3OH(g)ΘΪH2O(g) ΓςH1ΘΫ-49.1 kJΓΛmolΘ≠1
2CH3OH(g)![]() CH3OCH3(g)ΘΪH2O(g) ΓςH2ΘΫ-24.5 kJΓΛmolΘ≠1
CH3OCH3(g)ΘΪH2O(g) ΓςH2ΘΫ-24.5 kJΓΛmolΘ≠1
–¥≥ωCO2(g)ΚΆH2(g)ΉΣΜ·ΈΣCH3OCH3(g)ΚΆH2O(g)ΒΡ»»Μ·―ßΖΫ≥Χ Ϋ_______________ΓΘ
Θ®3Θ©ΕΰΦΉΟ―»ΦΝœΒγ≥ΊΨΏ”–ΡήΝΩΉΣΜ·¬ ΗΏΓΔΒγΝΩ¥σΒΡΧΊΒψΕχ±ΜΙψΖΚ”Π”ΟΘ§“Μ÷÷ΕΰΦΉΟ――θΤχΒγ≥ΊΘ®ΒγΫβ÷ ΈΣKOH»ή“ΚΘ©ΒΡΗΚΦΪΖ¥”Π ΫΈΣΘΚ_________________________ΓΘ
Θ®4Θ©≥ΘΈ¬œ¬Θ§”ΟNaOH»ή“ΚΉςCO2≤ΕΉΫΦΝ≤ΜΫωΩ…“‘ΫΒΒΆΧΦ≈≈Ζ≈Θ§Εχ«“Ω…ΒΟΒΫ÷Ί“ΣΒΡΜ·ΙΛ≤ζΤΖNa2CO3ΓΘ
ΔΌ»τΡ≥¥Έ≤ΕΉΫΚσΒΟΒΫpH=10 ΒΡ»ή“ΚΘ§‘ρ»ή“Κ÷–c(CO32-)ΓΟc(HCO3-)=_______________ΓΘ[≥ΘΈ¬œ¬K1(H2CO3
ΔΎ”ϊ”Ο2LNa2CO3»ή“ΚΫΪ4.66gBaSO4 ΙΧΧε»ΪΕΦΉΣΜ·ΈΣBaCO3Θ§‘ρΥυ”ΟΒΡNa2CO3»ή“ΚΒΡΈο÷ ΒΡΝΩ≈®Ε»÷Ν…ΌΈΣ__________________________ΓΘ[“―÷ΣΘΚ≥ΘΈ¬œ¬Ksp(BaSO4)=1ΓΝ10-11Θ§Ksp(BaCO3)=1ΓΝ10-10]ΓΘΘ®Κω¬‘»ή“ΚΧεΜΐΒΡ±δΜ·Θ©
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ‘Ύ“ΜΕ®ΧθΦΰœ¬ΖΔ…ζΖ¥”ΠΘΚ4NO2(g)ΘΪO2(g)![]() 2N2O5(g) ΠΛH<0Θ§T1 ±Θ§œρΧεΜΐΈΣ2LΒΡΚψ»ίΟή±’»ίΤς÷–Ά®»κNO2ΚΆO2Θ§≤ΩΖ÷ Β―ι ΐΨί»γ±μΥυ ΨΓΘ
2N2O5(g) ΠΛH<0Θ§T1 ±Θ§œρΧεΜΐΈΣ2LΒΡΚψ»ίΟή±’»ίΤς÷–Ά®»κNO2ΚΆO2Θ§≤ΩΖ÷ Β―ι ΐΨί»γ±μΥυ ΨΓΘ
±Φδ/s | 0 | 5 | 10 | 15 |
c(NO2)/(molΓΛLΘ≠1) | 4.00 | 2.52 | 2.00 | c3 |
c(O2)/(molΓΛLΘ≠1) | 1.00 | c1 | c2 | 0.50 |
Θ®1Θ©0ΓΪ10sΡΎN2O5ΒΡΤΫΨυΖ¥”ΠΥΌ¬ ΈΣ___Θ§¥ΥΈ¬Ε»œ¬ΒΡΤΫΚβ≥Θ ΐΈΣ___ΓΘ
Θ®2Θ©ΤδΥϊΧθΦΰ≤Μ±δΘ§ΫΪ»ίΤςΧεΜΐ―ΙΥθ“ΜΑκΘ§‘ρ÷Ί–¬¥οΒΫΤΫΚβ ±c(N2O5)___2.00molΓΛLΘ≠1Θ®ΧνΓΑ>ΓΔ<Μρ=Γ±Θ§œ¬Ά§Θ©
Θ®3Θ©ΦΌ…ηΈ¬Ε»T1 ±ΤΫΚβ≥Θ ΐΈΣK1Θ§Έ¬Ε»T2 ±ΤΫΚβ≥Θ ΐΈΣK2Θ§»τK1<K2Θ§‘ρT1__T2ΓΘ
Θ®4Θ©ΗΡ±δΡΡ–©¥κ ©Ω…“‘‘ωΦ”NO2ΒΡΤΫΚβΉΣΜ·¬ ___Θ®¥π≥ω»Έ“βΝΫΧθΦ¥Ω…Θ©
Θ®5Θ©“―÷ΣΘΚN2(g)+O2(g)=2NO(g) ΠΛH=+180.5kJΓΛmol1
2C(s)+O2(g)=2CO(g) ΠΛH=©¹221.0kJΓΛmol1
C(s)+O2(g)=CO2(g) ΠΛH=©¹393.5kJΓΛmol1
‘ρΤϊ≥ΒΈ≤Τχ¥ΠάμΒΡΖ¥”Π÷°“ΜΘΚ2NO(g)+2CO(g)=N2(g)+2CO2(g)ΓςH=___kJ/molΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΙΊ”Ύ»γΆΦΥυ ΨΗςΉΑ÷ΟΒΡ–π ω÷–Θ§’ΐ»ΖΒΡ «
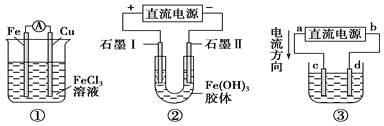
A. ΉΑ÷ΟΔΌ «‘≠Βγ≥ΊΘ§ΉήΖ¥”Π «ΘΚCuΘΪ2Fe3ΘΪ=Cu2ΘΪΘΪ2Fe2ΘΪ
B. ΉΑ÷ΟΔΌ÷–Θ§ΧζΉςΗΚΦΪΘ§ΒγΦΪΖ¥”Π ΫΈΣΘΚFe3ΘΪΘΪeΘ≠=Fe2ΘΪ
C. ΉΑ÷ΟΔΎΆ®Βγ“ΜΕΈ ±ΦδΚσ ·ΡΪΔρΒγΦΪΗΫΫϋ»ή“ΚΚλΚ÷…ΪΦ”…ν
D. »τ”ΟΉΑ÷ΟΔέΨΪΝΕΆ≠Θ§‘ρdΦΪΈΣ¥÷Ά≠Θ§cΦΪΈΣ¥ΩΆ≠Θ§ΒγΫβ÷ »ή“ΚΈΣCuSO4»ή“Κ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Ι”Ο ·”Ά»»Ν―ΫβΒΡΗ±≤ζΈο÷–ΒΡΦΉΆιά¥÷Τ»Γ«βΤχΘ§–η“ΣΖ÷ΝΫ≤ΫΫχ––Θ§ΤδΖ¥”ΠΙΐ≥Χ÷–ΒΡΡήΝΩ±δΜ·»γΆΦΥυ ΨΘΚ
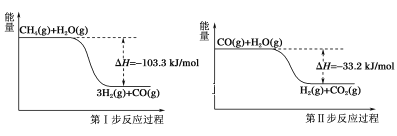
‘ρΦΉΆιΚΆΥ°’τΤχΖ¥”Π…ζ≥…Εΰ―θΜ·ΧΦΚΆ«βΤχΒΡ»»Μ·―ßΖΫ≥Χ ΫΈΣΘ® Θ©
A.CH4(g)ΘΪH2O(g)=3H2(g)ΘΪCO(g) ΠΛHΘΫΘ≠103.3kJ/mol
B.CH4(g)ΘΪ2H2O(g)=4H2(g)ΘΪCO2(g) ΠΛHΘΫΘ≠70.1kJ/mol
C.CH4(g)ΘΪ2H2O(g)=4H2(g)ΘΪCO2(g) ΠΛHΘΫ70.1kJ/mol
D.CH4(g)ΘΪ2H2O(g)=4H2(g)ΘΪCO2(g) ΠΛHΘΫΘ≠136.5kJ/mol
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–Μ·―ßΖΫ≥Χ Ϋ ι–¥¥μΈσΒΡ «
A.““¥Φ¥ΏΜ·―θΜ·÷Τ»Γ““»©ΘΚ2CH3CH2OHΘΪO2![]() 2CH3CHOΘΪ2H2O
2CH3CHOΘΪ2H2O
B.±Ϋ”κ≈®ΝρΥαΓΔ≈®œθΥαΒΡΜλΚœ“ΚΙ≤»»÷ΤœθΜυ±ΫΘΚ![]()
C.““ΥαΚΆ““¥ΦΖΔ…ζΖ¥”Π…ζ≥…““Υα““θΞΘΚCH3CH2OHΘΪCH3COOH![]() CH3COOC2H5ΘΪH2O
CH3COOC2H5ΘΪH2O
D.““œ© ΙδεΒΡΥΡ¬»Μ·ΧΦ»ή“ΚΆ …ΪΘΚCH2=CH2ΘΪBr2ΓζCH2BrΓΣCH2Br
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΘ®7Ζ÷Θ©”–“‘œ¬Έο÷ ΘΚ
ΔΌ ·ΡΪΘΜΔΎ¬ΝΘΜΔέΨΤΨΪΘΜΔήΑ±Υ°ΘΜΔίΕΰ―θΜ·ΧΦΘΜΔόΧΦΥα«βΡΤΙΧΧεΘΜ
ΔΏ«β―θΜ·±Β»ή“ΚΘΜΔύ¥Ω¥ΉΥαΘΜΔα―θΜ·ΡΤΙΧΧεΘΜΔ⬻̷«βΤχΧεΓΘ
Θ®1Θ©Τδ÷–ΡήΒΦΒγΒΡ «ΓΓΓΓΓΓΓΓΓΓΓΓΘΜ τ”ΎΖ«ΒγΫβ÷ ΒΡ «ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΘΜ
τ”Ύ«ΩΒγΫβ÷ ΒΡ «ΓΓΓΓΓΓΓΓΓΓΓΓΘΜ τ”Ύ»θΒγΫβ÷ ΒΡ «ΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΘ
Θ®2Θ©–¥≥ωΈο÷ Δό»ή”ΎΥ°ΒΡΒγάκΖΫ≥Χ ΫΘΚΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΘ
Θ®3Θ©–¥≥ωΈο÷ ΔόΚΆΔύ‘ΎΥ°÷–Ζ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΘΚΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΓΘ
Θ®4Θ©ΫΪΈο÷ Δό≈δ÷Τ≥…»ή“ΚΘ§÷πΒΈΦ”»κΔΏ»ή“Κ÷–÷Ν≥ΝΒμΝΩΉν¥σΘ§–¥≥ωάκΉ”ΖΫ≥Χ ΫΘΚΓΓΓΓΓΓΓΓΓΓΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ“―÷ΣΘΚ![]() ±
±
Μ·―ß Ϋ |
|
|
|
ΒγάκΤΫΚβ≥Θ ΐ |
|
|
|
œ¬Ν–ΥΒΖ®’ΐ»ΖΒΡ « ( )
A. ¥ΉΥαœΓ ΆΙΐ≥Χ÷–Θ§![]() ÷πΫΞΦθ–Γ
÷πΫΞΦθ–Γ
B. ![]() »ή“Κ÷–ΘΚ
»ή“Κ÷–ΘΚ![]()
C. œρ¥ΉΥαΜρHCN»ή“Κ÷–Φ”»κ![]() ,Ψυ≤ζ…ζ
,Ψυ≤ζ…ζ![]()
D. Έο÷ ΒΡΝΩ≈®Ε»œύΆ§ ±![]()
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “÷Τ±Η1,2Εΰδε““ΆιΒΡΖ¥”Π‘≠άμ»γœ¬ΘΚCH3CH2OH![]() CH2=CH2ΓϋΘΪH2OΘ§CH2=CH2ΘΪBr2ΓζBrCH2CH2BrΓΘ”Ο…ΌΝΩΒΡδεΚΆΉψΝΩΒΡ““¥Φ÷Τ±Η1,2Εΰδε““ΆιΒΡΉΑ÷Ο»γœ¬ΆΦΥυ ΨΘΚ
CH2=CH2ΓϋΘΪH2OΘ§CH2=CH2ΘΪBr2ΓζBrCH2CH2BrΓΘ”Ο…ΌΝΩΒΡδεΚΆΉψΝΩΒΡ““¥Φ÷Τ±Η1,2Εΰδε““ΆιΒΡΉΑ÷Ο»γœ¬ΆΦΥυ ΨΘΚ
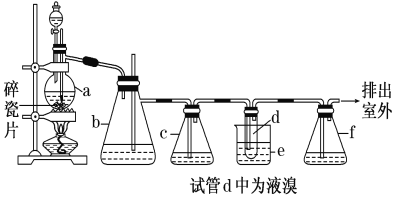
”–ΙΊ ΐΨίΝ–±μ»γœ¬ΘΚ
““¥Φ | 1,2Εΰδε““Άι | ““Ο― | |
Ή¥Χ§ | Έό…Ϊ“ΚΧε | Έό…Ϊ“ΚΧε | Έό…Ϊ“ΚΧε |
ΟήΕ»/gΓΛcmΘ≠3 | 0.79 | 2.2 | 0.71 |
Ζ–Βψ/Γφ | 78.5 | 132 | 34.6 |
»έΒψ/Γφ | Θ≠130 | 9 | Θ≠116 |
ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)‘ΎΉΑ÷Οc÷–”ΠΦ”»κ________(―ΓΧν–ρΚ≈)Θ§ΤδΡΩΒΡ «Έϋ ’Ζ¥”Π÷–Ω…Ρή…ζ≥…ΒΡΥα–‘ΤχΧεΓΘ
ΔΌΥ° ΔΎ≈®ΝρΥα Δέ«β―θΜ·ΡΤ»ή“Κ Δή±ΞΚΆΧΦΥα«βΡΤ»ή“Κ
(2)≈–ΕœdΙή÷–÷Τ±ΗΕΰδε““ΆιΖ¥”Π“―Ϋα χΒΡΉνΦρΒΞΖΫΖ® «________ΓΘ
(3)ΫΪΕΰδε““Άι¥÷≤ζΤΖ÷Ο”ΎΖ÷“Κ¬©ΕΖ÷–Φ”Υ°Θ§’ώΒ¥ΚσΨ≤÷ΟΘ§≤ζΈο”Π‘ΎΥ°ΒΡ________(ΧνΓΑ…œΓ±ΜρΓΑœ¬Γ±)≤ψΓΘ
(4)»τ≤ζΈο÷–”–…ΌΝΩΈ¥Ζ¥”ΠΒΡBr2Θ§ΉνΚΟ”Ο________(Χν’ΐ»Ζ―Γœν«ΑΒΡ–ρΚ≈)œ¥Β”≥ΐ»ΞΓΘΔΌΥ°ΓΓΔΎ«β―θΜ·ΡΤ»ή“ΚΓΓΔέΒβΜ·ΡΤ»ή“ΚΓΓΔή““¥Φ
Θ®5Θ©Ζ¥”ΠΙΐ≥Χ÷––η”ΟάδΥ°ά以(ΉΑ÷Οe)Θ§ ΒΪ≤Μ”Ο±υΥ°Ϋχ––ΙΐΕ»ά以ȧ‘≠“ρ__________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com