
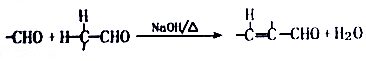
 .
.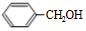 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2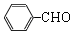 +H2O.
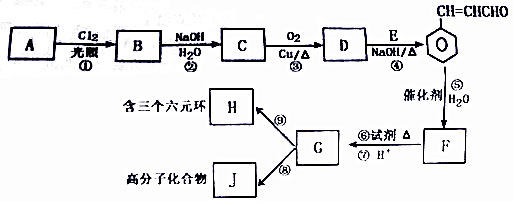
+H2O.分析 A是苯的同系物,分子组成符合CnH2n-6,分子中C、H两种元素的质量比为21:2,则n:(2n-6)=$\frac{21}{12}$:$\frac{2}{1}$=7:8,解得n=7,故A的分子式为C7H8,其结构简式为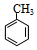 .A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化生成D,D与E发生信息中反应生成
.A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化生成D,D与E发生信息中反应生成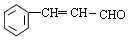 ,可推知B为
,可推知B为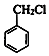 、C为
、C为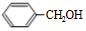 、D为
、D为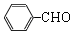 、E为CH3CHO,
、E为CH3CHO,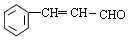 与水发生加成反应生成F,F转化得到G,G可以形成含有3个六元环的H,也可以形成高分子化合物J,可推知G中含有羧基、羟基,且羧基与羟基连接同一碳原子上,则F为
与水发生加成反应生成F,F转化得到G,G可以形成含有3个六元环的H,也可以形成高分子化合物J,可推知G中含有羧基、羟基,且羧基与羟基连接同一碳原子上,则F为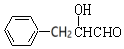 、G为
、G为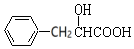 、H为
、H为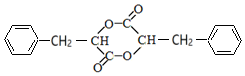 、J为
、J为 .
.
解答 解:A是苯的同系物,分子组成符合CnH2n-6,分子中C、H两种元素的质量比为21:2,则n:(2n-6)=$\frac{21}{12}$:$\frac{2}{1}$=7:8,解得n=7,故A的分子式为C7H8,其结构简式为 .A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化生成D,D与E发生信息中反应生成
.A与氯气在光照条件下发生甲基上取代反应生成B,B发生卤代烃的水解反应生成C,C发生催化氧化生成D,D与E发生信息中反应生成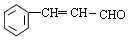 ,可推知B为
,可推知B为 、C为
、C为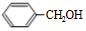 、D为
、D为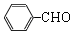 、E为CH3CHO,
、E为CH3CHO,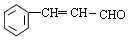 与水发生加成反应生成F,F转化得到G,G可以形成含有3个六元环的H,也可以形成高分子化合物J,可推知G中含有羧基、羟基,且羧基与羟基连接同一碳原子上,则F为
与水发生加成反应生成F,F转化得到G,G可以形成含有3个六元环的H,也可以形成高分子化合物J,可推知G中含有羧基、羟基,且羧基与羟基连接同一碳原子上,则F为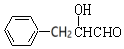 、G为
、G为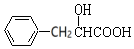 、H为
、H为 、J为
、J为 .
.
(1)由上述分析可知,E的结构简式为CH3CHO,F为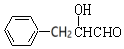 ,含氧官能团名称为醛基、羟基,
,含氧官能团名称为醛基、羟基,
故答案为:CH3CHO;醛基、羟基;
(2)反应⑤是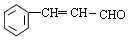 与水发生加成反应生成
与水发生加成反应生成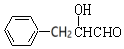 ,
,
故答案为:加成反应;
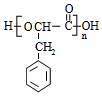
(3)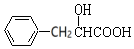 发生缩聚反应得到高分子化合物J的结构简式为:
发生缩聚反应得到高分子化合物J的结构简式为: ,
,
故答案为: ;
;
(4)反应③的化学方程式为:2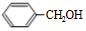 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2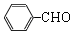 +H2O,
+H2O,
故答案为:2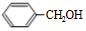 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2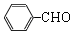 +H2O;
+H2O;
(5)反应⑥是将醛基转化为羧基,所用试剂为:银氨溶液或新制氢氧化铜悬浊液,
故答案为:银氨溶液或新制氢氧化铜悬浊液;
(6)G(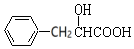 )有多种同分异构体符合条件:a:能发生水解反应,说明含有酯基;b:遇FeCl2溶液显紫色,说明含有酚羟基,c:有两个取代基,其中一个为-OH,另外取代基为-CH2CH2OOCH,或者为-CH(CH3)OOCH,或者-CH2COOCH3,或者为-CH2OOCCH3,或者为-COOCH2CH3,或者为-OOCCH2CH3,各有邻、间、对三种,共有18种,
)有多种同分异构体符合条件:a:能发生水解反应,说明含有酯基;b:遇FeCl2溶液显紫色,说明含有酚羟基,c:有两个取代基,其中一个为-OH,另外取代基为-CH2CH2OOCH,或者为-CH(CH3)OOCH,或者-CH2COOCH3,或者为-CH2OOCCH3,或者为-COOCH2CH3,或者为-OOCCH2CH3,各有邻、间、对三种,共有18种,
故答案为:18.
点评 本题考查有机物的推断,需要学生熟练掌握官能团的性质与转化,确定A的结构简式,结合反应条件、反应④产物的结构简式及H的结构特点、J为高分子化合物等进行推断,较好的考查学生分析推理能力、自学能力.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作 |
| A | 除去NH4Cl溶液中的Fe3+ | 加入氨水至不再产生沉淀为止,然后过滤 |
| B | 检验某溶液中是否存在SO32- | 取少量溶液于试管中,滴加盐酸酸化的硝酸钡 |
| C | 证明Mg的金属性强于Al | 分別向MgCl2、AlCl3的溶液中加人足量的氨水 |
| D | 配制 100 mL0.lmol•L-1H2SO4溶液 | 用量筒量取 20 mL 0.5 mol•L-1 H2SO4 溶液沿玻璃棒注入含有80mL水的烧杯中 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
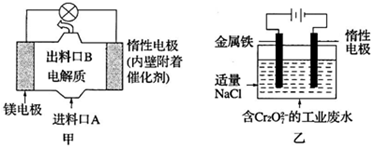
| A. | 图甲中发生的氧化反应是Mg2++ClO-+H2O+2e-═Cl-+Mg(OH)2↓ | |
| B. | 图乙中惰性电极棒上有O2放出 | |
| C. | 图乙中Cr2O72-向惰性电极移动,与该极近的OH-结合转化成Cr(OH)3除去 | |
| D. | 若图甲中3.6g镁产生的电量用于图乙废水处理,理论上图乙中有8.4g阳极材料参与反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
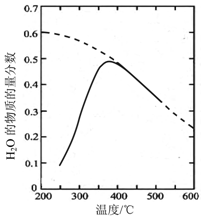 航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:
航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用,Sabatier反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
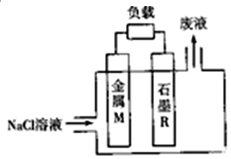 金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )
金属染料电池是一类特殊的染料电池,具有成本低、无毒、无污染、比功率高、比能量高(比能量可用单位质量金属提供电子多少来表示)等优点.锌、铁、铝、锂等金属都可用在金属燃料电池中,电池的基本结构如图所示:下列说法正确的是( )| A. | 电池工作时,电子沿M电极→电解质溶液→R电极流动 | |
| B. | 电池工作时,正极附近溶液的pH增大 | |
| C. | 在锌、铁、铝、锂中,锂的比能量最高 | |
| D. | 若M为锌时,电池反应为 Zn+2H2O═Zn(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用二氧化硫来漂白纸浆、丝毛、草帽以及给食品增白 | |
| B. | 浓硫酸可以用来干燥SO2、CO2 H2等气体 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| D. | 稀硝酸在空气中可以通过加热浓缩的方法增大溶液的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com