
【题目】某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是_____。
(2)已知0.2molKBrO3在反应中得到1mol电子生成X,则X的化学式为:_____。
(3)根据上述反应可推知_____。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(4)根据上述条件写出化学方程式,并用单线桥表示电子转移。__________。
【答案】AsH3 Br2 ac 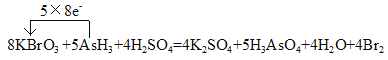
【解析】
(1)KBrO3在反应中得到电子,则还原剂应该在反应中失去电子,元素化合价升高,所以在反应物中元素价态低,分析给出的物质可知还原剂是AsH3,生成的氧化产物是H3AsO4;
(2)0.2molKBrO3在反应中得到1mol电子生成X,则Br元素化合价降低5价,由于在KBrO3中Br元素化合价为+5价,所以反应产生的X的价态为0,其化学式为Br2;
(3)在化学反应中,根据氧化剂:氧化剂>氧化产物;还原性:还原剂>还原产物。由于KBrO3将AsH3氧化为H3AsO4,KBrO3被还原为Br2,可知氧化性:KBrO3>H3AsO4,还原性:AsH3>Br2,所以选项ac合理;
(4)根据电子守恒、原子守恒,可得该反应的化学方程式为:8KBrO3+5AsH3+4H2SO4=4K2SO4 +5H3AsO4+4H2O+4Br2,As元素的化合价由反应前AsH3中的-3价变为反应后中的+5价,失去5×8e-;Br元素的化合价由反应前KBrO3中的+5价变为反应后Br2中的0价,得到8×5e-,用单线桥法表示电子转移为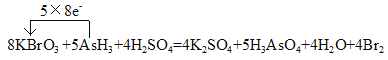 。
。


科目:高中化学 来源: 题型:
【题目】下列实验操作中一定会产生误差的是
A.在中和热的测定实验中用Ba(OH)2代替NaOH,用H2SO4代替HCl
B.将pH试纸用蒸馏水润湿后测某溶液的pH
C.用碱石灰来干燥氨气
D.使用天平称量时误将药品与砝码的位置放反
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,反应2SO2(g)+O2(g)![]() 2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积
2SO3(g);△H<0,在不同温度、不同压强(P1>P2) 下达到平衡时,混合气中SO3的体积![]() (SO3)随温度变化的曲线应为 ( )
(SO3)随温度变化的曲线应为 ( )
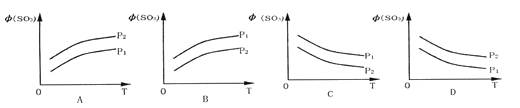
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把400mLNH4HCO3和Na2CO3的混合溶液分成两等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A. (b/10-a/20)mol/L B. (2b-a)mol/L C. (5b-5a/2)mol/L D. (10b-5a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于取代反应的是
A. 苯与氢气反应生成环己烷 B. 甲烷与氯气反应生成一氯甲烷
C. 乙醇与氧气反应生成乙醛 D. 乙烯与溴反应生成1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 X、Y、Z、Q、R、E六种前四周期元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表。
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 地壳中含量最多的元素 |
Q | 单质常温常压下是气体,原子的M层上有1个未成对的p电子 |
R | 核电荷数是Y与Q的核电荷数之和 |
E | N能层上只有一个电子,K、L、M层均排满电子 |
(1)写出元素Y的原子核外价电子排布图:________________。X的一种氢化物相对分子质量为26,其分子中的σ键与π键的键数之比为__________。
(2)X、Y、Z三种元素的第一电离能由高到低的排列为(写元素符号)__________。三种元素电负性由大到小的顺序为(填元素符号)_____________。
(3)X、Z元素分别与氢元素形成的最简单化合物中,沸点较高的为(写化学式)__________,原因是________________。
(4)XZ与Y2属于等电子体,写出化合物XZ的结构式:________________。
(5)R的一种配合物的化学式为RCl3·6H2O。已知0.01 mol RCl3·6H2O在水溶液中用过量硝酸银溶液处理,产生0.02 mol AgCl沉淀。此配合物最可能是________________。
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2·H2O
C.[R(H2O)4Cl2]Cl·2H2O D.[R(H2O)3Cl3]·3H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com