
NA代表阿伏加德罗常数的值,下列说法正确的是( )
A.2.3 g钠由原子变成离子时,失去的电子数为0.1 NA
B.0.2 NA个硫酸分子与19.6 g磷酸含有相同的氧原子数
C.22.4 L氮气所含的原子数为2 NA
D.1 L 1 mol/L硝酸钙溶液中的离子总数为2 NA
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
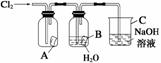
(1)通Cl2一段时间后,A中观察到的现象是__________________________,B中观察到的现象是________________________________,由此可得出的结论是_______,写出有关反应的化学方程式:_____________________________________________________________。
(2)C装置的作用是____________________________________,理由是______,写出有关反应的化学方程式:_________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室保存下列试剂的方法不正确的是
A.钠保存在煤油中 B.用带玻璃塞的试剂瓶盛放NaOH溶液
C.用棕色试剂瓶盛放新制的氯 D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| I | 向2 mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,用化学平衡移动原理解释溶液呈红褐色的原因:________。
 ② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:
② 乙同学认为可能是发生了氧化还原反应,完成并配平其反应的离子方程式:





 Fe3+ + SO32- + == F e2+ + +
Fe3+ + SO32- + == F e2+ + +
乙同学查阅资料得知:
| 1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3; 2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。 |
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| II | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成如下实验:
| 步骤 | 操作 | 现象 |
| III | 向1 mol•L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| IV | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |
① 经检验步骤III中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是______(填字母)。
a.K3 溶液 b.KSCN溶液 c.KMnO4溶液
② 已知H2SO3是弱酸,请结合电离方程式说明步骤III中出现红褐色的原因: 。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
等质量的CuO和MgO粉末分别溶于相同体积的硝酸中,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L—1和 b mol·L—1,则a 与b 的关系为( )
A.a=b B. a=2b C. 2a=b D. a=5b
查看答案和解析>>
科目:高中化学 来源: 题型:
用物质的量都是0.1 mol的CH3COOH和CH3COONa配制成1L混合溶
液,已知其中[CH3COO-]>[Na+],对该混合溶液的下列判断正确的是 ( )
A. [H+]>[OH-] B. [CH3COOH]+[CH3COO-]=0.2 mol/L
C. [CH3COOH]>[CH3COO-] D. [CH3COO-]+[OH-]=0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在pH=1的溶液中,可以大量共存的离子组是
A. Na+、K+、S2-、Cl- B. Al3+、Mg2+、SO42-、Cl-
C. K+、Na+、AlO2-、NO3- D. K+、Na+、SO42-、S2O32-
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定某溶液中只含NH4+、C1-、H+、OH-四种离子,下列说法错误的是
A.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H2O
B.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA;HA-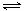 H++A2- 回答下列问题:
H++A2- 回答下列问题:
⑴Na2A溶液显(填“酸性”,“中性”,或“碱性”)。
理由是: (用离子方程式表示)
⑵在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系式正确的是: 。
A. c(A2-) +c( HA-)+c( H2A) =0.1mol·L-1 B. c(OH-)=c(H+) +c( HA-)
C. c(Na+ )+ c(H+) =c(OH-)+ c( HA-)+2c(A2-) D. c(Na+ )= 2c(A2-) +2c( HA-)
⑶已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是 < 0.11 mol·L-1(填“<”,“>”,或“=”),理由是: 。
⑷0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com