
下列实验过程中产生沉淀的物质的量(Y) 与加入试剂的量(X)之间的关系正确的是( )
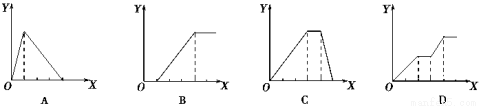
A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量
C
【解析】
试题分析:A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡,先产生氢氧化铝沉淀:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续滴加NaOH溶液,Al(OH)3和NaOH溶液反应,生成偏铝酸钠,沉淀溶【解析】
NaOH+Al(OH)3=NaAlO2+2H2O,所以沉淀量达到最大消耗NaOH,和沉淀溶解消耗NaOH的比为3:1;故A错误;B.向NaAlO2溶液中滴加稀盐酸,开始阶段先产生氢氧化铝沉淀,发生反应:AlO2-+H++H2O=Al(OH)3↓,随着盐酸的逐滴加入,则沉淀开始溶解,发生反应:Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3.故B错误;C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3?H2O;NH4+,此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH,沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;故C正确;D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,产生沉淀,然后发生反应:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,又发生反应:CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2,沉淀部分溶解,故图象错误,D错误;故选:C。
考点:考查化学反应与图象的关系


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源:2015届湖北黄冈蕲春县第一高级中学高二下期中考试化学卷(解析版) 题型:填空题
(14分)肉桂酸异戊酯G(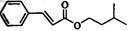 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
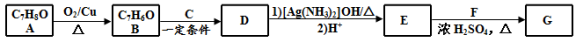
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3︰1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三十月阶段性考试化学试卷(解析版) 题型:填空题
(10分)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。
(1)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,产物中含氮的物质为__________(填化学式)。
(2)要得到稳定的HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是_________(填序号)。
A.稀硫酸 B.二氧化碳 C.二氧化硫 D.磷酸
(3)工业废水中的NO2-可用铝粉除去.已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质.将氧化剂和还原剂的化学式及其配平后的系数填入下列横线上:_________________________ + _________________________
上述反应后废水的pH值将________(填“增大”、“减小”或“不变”)。
(4)向20mL 0.01mol·L-1的NaNO2溶液中加入10mL 0.01 mol·L-1的AgNO3溶液,一段时间后,溶液中的c(Ag+)=________________________________。(已知:KSP(AgNO2)=2×10-8 mol2·L-2)
查看答案和解析>>
科目:高中化学 来源:2015届湖北省高三十月阶段性考试化学试卷(解析版) 题型:选择题
下列离子能够大量共存的是
A.无色溶液中:Fe3+、Na+、NO3-、Cl-
B.pH=0的溶液中:Fe2+、NO3-、Cl-、HCO3-
C.含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+
D.与铝作用生成氢气的溶液:Mg2+、NO3-、K+、Cl-
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:填空题
(12分)某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
阴离子 | Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为 mol/L(精确到千分位)
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论错误的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2 min后,试管里 出现凝胶 | 酸性:盐酸>硅酸 |
B | 向蛋白质溶液中滴加饱和CuSO4溶液 | 有固体析出 | 蛋白质发生变性 |
C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硫酸反应 |
D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象, 后溶液变成血红色 | 溶液中含有Fe2+,没有Fe3+ |
查看答案和解析>>
科目:高中化学 来源:2015届湖北省四校高三上学期期中联考化学试卷(解析版) 题型:选择题
2013年下半年,武汉雾霾天气特别多,空气污染严重。湖北省决定在“十二五”期间,将大力实施“清水蓝天”工程。不利于“清水蓝天”工程实施的是 ( )
A.加强城市生活污水脱氮除磷处理,遏制水体富营养化
B.为防止电池中的重金属污染,废旧电池应作深埋处理
C.积极推广太阳能、风能、地热能及水能等的使用,减少化石燃料的使用
D.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
查看答案和解析>>
科目:高中化学 来源:2015届湖北省咸宁市高三三校联考化学试卷(解析版) 题型:选择题
下列有关阿伏加德罗常数说法正确的组合是
①标准状况下,22.4L氯气与足量的热NaOH溶液反应,转移电子数目为NA
②25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-数目为0.2 NA
③电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子数不一定等于2NA
④标准状况下,33.6L氟化氢含有氟原子的数目为1.5NA
⑤2.24LCO2和2.8gN2组成的混合物中质子数为2.8 NA
⑥14gN60(分子空间结构类似C60)中含有的N—N键数目为1.5 NA
A.③⑥ B.①③⑥ C.①③④⑥ D.①②⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届浙江省协作体高三第一次适应性测试理科综合化学卷(解析版) 题型:选择题
已知25℃时Mg(OH)2的Ksp为5.6×10-12mol3·L-3,MgF2的Ksp为7.4×10-11mol3·L-3。下列说法中正确的是( )
A.25℃时,Mg(OH)2固体在氨水中的Ksp比在NH4Cl溶液中的Ksp小
B.25℃时,向Mg(OH)2的澄清饱和溶液中加入少量NH4Cl固体,c(Mg2+)减小
C.25℃时,Mg(OH)2的溶解能力大于MgF2的溶解能力
D.25℃时,饱和Mg(OH)2溶液与0.1mol·L-1NaF溶液等体积混合,能生成MgF2沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com