
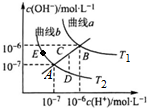
| A. | 图中温度T2>T1 | |
| B. | 曲线a、b均代表纯水的电离情况 | |
| C. | 图中五点的Kw的关系:B>C>A>D=E | |
| D. | 若处在B点时,将pH=2的硫酸溶液与pH=12的KOH溶液等体积混合后,溶液呈碱性 |
分析 A.水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大;
B.只有c(OH-)=c(H+)的点是纯水的电离;
C.水的离子积常数只与温度有关,温度越高,离子积常数越大;
D.B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,等体积混合碱剩余,溶液呈碱性.
解答 解:A.水的电离是吸热反应,升高温度促进水电离,则水中c(H+)、c(OH-)及离子积常数增大,根据图知,T1曲线上离子积常数大于T2,所以T1>T2,温度,故A错误;
B.只有c(OH-)=c(H+)的点是纯水的电离,所以只有A、B点才是纯水的电离,故B错误;
C.水的离子积常数只与温度有关,温度越高,离子积常数越大,同一曲线是相同温度,根据图知,温度高低点顺序是B>C>A=D=E,所以离子积常数大小顺序是B>C>A=D=E,故C错误;
D.B点时,Kw=1×10-12,pH=2的硫酸中c(H+)=0.01mol/L,pH=12的KOH溶液中c(OH-)=1mol/L,等体积混合时碱剩余,溶液呈碱性,故D正确;
故选D.
点评 本题考查弱电解质的电离,题目难度中等,注意分析图象,把握水的离子积只受温度的影响.


科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.中子数为10的氧原子: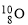
 B.Mg2+的结构示意图:
B.Mg2+的结构示意图: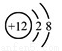
C.硫化钠的电子式: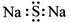 D.甲酸甲酯的结构简式:C2H4O2
D.甲酸甲酯的结构简式:C2H4O2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯化反应也属于加成反应 | |
| B. | 酯化反应中酸脱去羟基,醇脱去氢原子 | |
| C. | 浓硫酸在酯化反应中只起催化剂的作用 | |
| D. | 乙酸乙酯的结构简式为CH3COOCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 实验现象 | 解释 |
| A | 反萃取法提取碘的CCl4溶液中的碘 | 向富碘的CCl4溶液中加入足量水、振荡、静置、分液 | 碘在水中溶解度比在CCl4中大 |
| B | 在FeCl3溶液中加入适量Fe粉充分反应后,再滴加几滴黄色铁氰化钾溶液 | 产生蓝色沉淀 | 2Fe3++Fe═3Fe2+ 3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
| C | 向0.1mol/L的Fe(NO3)2溶液中滴加盐酸 | 振荡试管颜色加深 | H+抑制Fe2+水解 |
| D | 让蛋白质从水溶液中析出 | 将CuSO4溶液加入蛋白质中发生盐析 | 重金属无机盐溶液可降低蛋白质的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
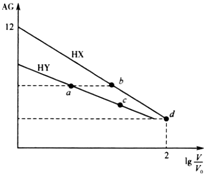 常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )
常温下,浓度均为0.10mol•L-1、体积均为V0的HX和HY溶液,分别加水稀释至体积V,AG[AG=$\frac{c({H}^{+})}{c(O{H}^{-})}$]随1g$\frac{V}{{V}_{0}}$的变化如图所示.下列叙述正确的是( )| A. | a、b溶液中导电离子数目相等 | |
| B. | 水的电离程度:a<b<c | |
| C. | d点所示溶液的AG=8 | |
| D. | 与等浓度的NaOH溶液中和时,c点消耗NaOH溶液的体积大于a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和.
有M、X、Y、Z、Q五种元素.M元素的电负性在所有元素中最大,X原子最外层电子数比内层电子总数多1;Y原子s轨道和p轨道电子数相同,且有2个单电子;Z原子核外有3种能级,每种能级所含电子数相同;Q的原子序数为M、Y、Z原子序数之和. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
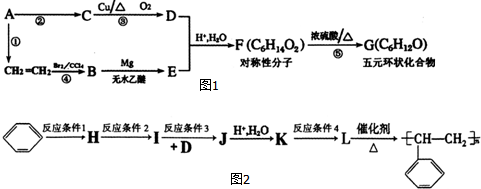
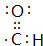 .
.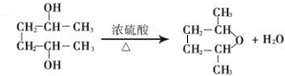 .
.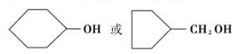 .
.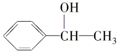 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com